GMPヒューマンエラー防止のための文書管理【第13回】

1.教育訓練の徹底
例えば、逸脱、特にヒューマンエラーでその再発防止策として「教育訓練の徹底」としていないだろうか。神奈川県庁薬務課に在籍していた時、回収等の違反で、その報告書に「教育訓練の徹底」と記載されるケースを目にした。しかし、「教育訓練の徹底」では、是正措置になっていないと受け取らないこともあった。まず、考えてもらいたいのは、その逸脱が起きた原因は何かをきちんと原因究明することである。その原因が不明だとしても、推測でもよい。本当に、教育訓練が不足していたのか考えなくてはならない。教育訓練が原因だと判断するなら、その教育の内容を作業者が理解したかの評価はどうであったか確認したであろうか。教育訓練の理解度評価が適切に行われた記録が必要である。また、その教育訓練の時間は十分であったか。教育訓練の方法が手順書の読み聞かせだけで、OJTとして教育をしていないのか。教育訓練の内容について確認した上で、教育訓練の理解度評価はどうであったのか確認しなければならない。アンケートのみか。テストを行ったか。OJTとして実作業を見て評価したか。教育訓練が不足していたかの確認だけでもこれだけ考えられる。特性要因図から考えて、他に原因となる点はなかったか。SOPは読みにくい点がなかったか。手順書はどこに保存して、作業時にSOPは確認できる状態になっていたか。SOPと製造指図書に齟齬がないか。作業者はどちらを見て作業をしているかを確認しなくてはならない。また、製造環境はどのようになっていたか。5S活動がされ、作業がしやすい環境か。設備のメンテナンスがされていたか。設備のSOPは、読みやすくなっていたか。その是正措置を実施する前に、原因究明に問題がなかったかを確認してほしい。「教育訓練の徹底」では、是正措置とはならない。そして、その教育訓練の効果があり、作業者にスキルが身についたかを確認することが必要である。

教育訓練をPDCAサイクルで運用する時、Check(評価)を教育訓練対象者の評価だけにしてはならない。Check(評価)は、その教育そのものが有効であることを確認しなければならない。もし、教育訓練を受けた者の半数以上が理解できないならば、その教育方法自体を見直し、改善しなくてはならない。また、是正措置としての教育訓練を実施後、その逸脱が再発するようなことがあれば、教育訓練は有効なものではなかったと判断すべきである。是正措置として教育訓練を実施する時は、CAPAの有効性確認として、教育訓練対象者がその逸脱等の行為を再発しないかを確認することが重要である。
GMP事例集のGMP0-12で述べられているように、「CAPAが品質リスクマネジメントの一つではなく、CAPAを含めた品質システムの活動の中でこれらのプロセスを活用するべきである。」CAPAを実施するうえで、リスクマネジメントの考えを踏まえ、行う必要がある。では、どのように、リスクマネジメントの考えを取り入れるべきかを考える。
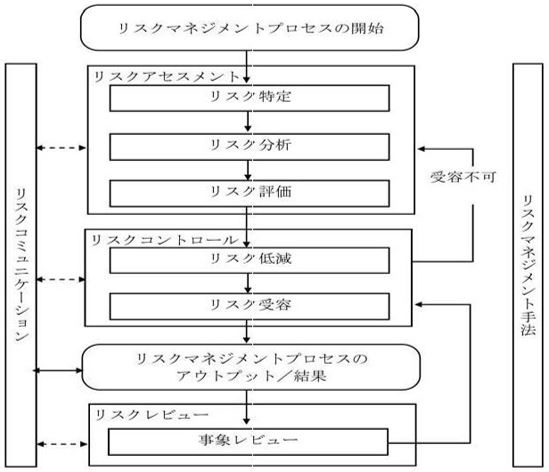
CAPAの処理をリスクマネジメントにおいて考える場合、原因究明はリスク分析となる。特性要因図などを用いて、原因を調査する。その原因究明した結果、必要な是正措置がリスクマネジメントにおける低減策であり、逸脱等のランク付けにもなる。逸脱の発生時にランク付けがされているが、さらに是正措置により、再発防止策が有効であることを検討し、最終的なレビューをすることになる。
例えば、逸脱、特にヒューマンエラーでその再発防止策として「教育訓練の徹底」としていないだろうか。神奈川県庁薬務課に在籍していた時、回収等の違反で、その報告書に「教育訓練の徹底」と記載されるケースを目にした。しかし、「教育訓練の徹底」では、是正措置になっていないと受け取らないこともあった。まず、考えてもらいたいのは、その逸脱が起きた原因は何かをきちんと原因究明することである。その原因が不明だとしても、推測でもよい。本当に、教育訓練が不足していたのか考えなくてはならない。教育訓練が原因だと判断するなら、その教育の内容を作業者が理解したかの評価はどうであったか確認したであろうか。教育訓練の理解度評価が適切に行われた記録が必要である。また、その教育訓練の時間は十分であったか。教育訓練の方法が手順書の読み聞かせだけで、OJTとして教育をしていないのか。教育訓練の内容について確認した上で、教育訓練の理解度評価はどうであったのか確認しなければならない。アンケートのみか。テストを行ったか。OJTとして実作業を見て評価したか。教育訓練が不足していたかの確認だけでもこれだけ考えられる。特性要因図から考えて、他に原因となる点はなかったか。SOPは読みにくい点がなかったか。手順書はどこに保存して、作業時にSOPは確認できる状態になっていたか。SOPと製造指図書に齟齬がないか。作業者はどちらを見て作業をしているかを確認しなくてはならない。また、製造環境はどのようになっていたか。5S活動がされ、作業がしやすい環境か。設備のメンテナンスがされていたか。設備のSOPは、読みやすくなっていたか。その是正措置を実施する前に、原因究明に問題がなかったかを確認してほしい。「教育訓練の徹底」では、是正措置とはならない。そして、その教育訓練の効果があり、作業者にスキルが身についたかを確認することが必要である。
教育訓練をPDCAサイクルで運用する時、Check(評価)を教育訓練対象者の評価だけにしてはならない。Check(評価)は、その教育そのものが有効であることを確認しなければならない。もし、教育訓練を受けた者の半数以上が理解できないならば、その教育方法自体を見直し、改善しなくてはならない。また、是正措置としての教育訓練を実施後、その逸脱が再発するようなことがあれば、教育訓練は有効なものではなかったと判断すべきである。是正措置として教育訓練を実施する時は、CAPAの有効性確認として、教育訓練対象者がその逸脱等の行為を再発しないかを確認することが重要である。
GMP事例集のGMP0-12で述べられているように、「CAPAが品質リスクマネジメントの一つではなく、CAPAを含めた品質システムの活動の中でこれらのプロセスを活用するべきである。」CAPAを実施するうえで、リスクマネジメントの考えを踏まえ、行う必要がある。では、どのように、リスクマネジメントの考えを取り入れるべきかを考える。
<典型的な品質リスクマネジメントの概要1)>
CAPAの処理をリスクマネジメントにおいて考える場合、原因究明はリスク分析となる。特性要因図などを用いて、原因を調査する。その原因究明した結果、必要な是正措置がリスクマネジメントにおける低減策であり、逸脱等のランク付けにもなる。逸脱の発生時にランク付けがされているが、さらに是正措置により、再発防止策が有効であることを検討し、最終的なレビューをすることになる。


コメント
/
/
/
コメント