ドマさんの徒然なるままに【第25話】


第25話:医薬品開発の点と線・Part 3
Part 3のはじめに
Part 1とPart 2も踏まえて、簡単におさらいしよう。前臨床から始まり、Phase 1 ⇒ Phase 2 ⇒ Phase 3と治験段階を経た後に申請という峠を越えて承認を獲得する。探索研究も含めた医薬品開発の流れ、少なくとも一般的な開発という意味では、それで終わる。ただ民間企業という立場から捉えれば、承認を受けて販売を開始した時点が本当のスタートである。そうでなければ儲けに繋がらない。利益が無ければ次なる新薬開発もままならぬ。製薬会社としての本来の目的はそこにある。
それぞれの時期や段階で、それぞれの担当者がおり、実務に勤しむ。それぞれはその時点や部署での点でしかない。それらの点をリレー走のごとくバトンタッチして繋げていって実を結ぶ。本Part 3では、点を繋いで線とするために我々が意識して行わなければならないことを再認識してみたい。なお、項目番号はPart 2からの続きとして付けている。
12. 会社としての本来の勝負に繋げたいじゃない
本話冒頭で述べたように、ビジネスとしての本来の勝負は上市してからである。しかもスタートダッシュが物を言う。その意味では、上市を見据えた準備と試行(俗に言うcommercializationという作業)も開発という部類の話なのではないか。上市後の実生産から輸送・保管などのサプライチェーンも想定しておかなくてはならない。まして、ワクチンや抗体医薬などのような温度管理が必要なものも多々ある。本シリーズではGDP領域について触れないが、それでも製造業者および製造販売業者としての保管や輸送はGMPの一環として対応しなければならない。今や製造場所が他国なんて当たり前の時代となった。
蛇足であるが、サプライチェーンについては、グローバル治験も普通に行われる状況となった昨今では、治験薬についても考慮しなくてはならない。特に、安定性試験データも不十分な開発初期における温度感受性の高い治験薬の温度管理については、Stability Budget*1もなく、安全性や有効性の申請データへの影響を考え合わせれば市販品以上の注意が必要であることを心しておきたい。
13. 教育訓練は大事だが、それで済みます?
一方で、保管や輸送の担当者は必ずしも医薬品(クスリ)についての知識があるわけではなく、単に指示や指図に従い行っているだけなのが現実。教育訓練だー、なんて言うのは簡単だが、製薬関係ではない方々にどれだけGMPやGDP云々の話が伝わるのか。作業という行為も、言われたままに意味も分からずやっているのと、目的や内容を理解してやっているのでは大違い。にも拘らず、前者であっても教育訓練を受けて、シッカリと受講記録なんかあったりする。別に皮肉を言うつもりはないが、そういう現実の問題があったりする。これじゃ、線として繋いだつもりでも、良く言ってもせいぜい点線や破線だよね。あくまで実線(実践のダジャレか?)として繋ぎたいよね。クスリの専門家である必要はないが、せめて最低限度を認識して貰って実線にしません!?
GMPやGDPの教育訓練が無意味だなんてことを言いたい訳じゃない。製薬専業企業ではない方々に対して、いきなりGMPやGDPを持ち出しても理解不能として毛嫌いされる可能性が高い(製薬専業企業内、しかも品質関係者でもGMPが分からないなんて声はよく聞いていましたが・・・)。だとしたら、GMPやGDPの条文といったことでなく、その本質として求められていることについて、もっと身近なこと、出来れば身内のことに置き換えて話してあげたらと思う次第である。
14. 患者さんへの、お・も・い・や・り
自分が開発しようとしているクスリ、市販品であれば自分の取り扱っているその製品は、「だれが、なんのために使うのか」ということ。その気づかいは、あなたの視線の先がどこに向いているかで決まる。「患者さんあってのクスリ」、「病気で苦しんでいる患者さんのために」、それだけのことである。
それは承認保有者の製造販売業者に限定されない。製造であれ試験検査であれ、保管・配送であれ、受託業者も同様である。受託業者にとっての直接の契約(ビジネス上の顧客)は製造販売業者であったとしても、クスリの存在意義を考えれば、真の顧客はエンドユーザーである患者さんである。この以下に図示する。

もし今研究開発しているクスリ、取り扱っているクスリを自分の家族が使うのだとしたら、どう扱います? 慎重かつ厳重に取り扱うんじゃないのか。知らない他人の者はいい加減で良いなんて言うつもりはないし、誰もそんなことはしないであろう。しかし、自分の愛する家族が使うとなれば、気の入れ方は変わるんじゃないのか。ほんのちょっとの差でしかない。ただ、そのほんのちょっとした差で品質が劣化する可能性だってある。だからこそ、そのほんのちょっとした気遣い・気配り、そう思いやりが大事なのである。
他人事ではなく自分事として考え行動すること、たったそれだけでいい。それだけでGMPとして求められていることの基本中の基本を満たすことに繋がるはずである。
あなたの視線の先にあるものはなんですか? 新型コロナウイルスに対するマスク着用や消毒だって同じことですよ。「自分が・・・」じゃなく、「他人に迷惑をかけたくないから・・・」といった些細な気づかい・気配りの差ですよ。医薬品の開発には、そんなちょっとした思いやりが欲しい。これが筆者の想いである。
15. 日本人らしさを出してみません?
前項での話、まさに日本人らしい発想による、日本人らしい対応だと思う。SOP通り、マニュアル通りの対応、それは治験薬・市販品を問わずGMPの基本であり、それはそれで大事なことである。しかし、それを実践するには、常識・良識という前提が必要である。さらに、筆者としては日本人の義理と人情といった浪花節的要素を加味したい。法規制としては謳えない、こんなことこそが日本人らしい性善説に基づく品質保証のベースなんじゃないかと思っている。
前Part 2で触れたように、形式的や見せかけのGMP・GQPによる不始末をしでかす会社が出れば、規制当局としてはより厳しい規制強化に走る。だが、どんなに規制強化したところで問題が無くなるかと言えば、率直言って、“イタチごっこ”になりかねない可能性がある。規制強化をとやかく言うつもりもないし、筆者自身、PIC/S GMPを尊重している。ただ、くどくて申し訳ないが、あくまで前提に「だれが、なんのために使うのか、患者さんあってのクスリだよ」という気持ちを忘れて欲しくない。どんな商売であれ、お客様が喜んでくれる(くれると思う)から頑張れるんじゃないのか? クスリだって同じなんじゃないの? ならば、「当たり前のこととして、当たり前の行動を図る」、これが一番大事なことなんじゃないのか。俗に言う“Quality Culture”だって、本質的にはマインドの醸成を求めているんじゃないの?
16. あなたの視線の先に患者さんは見えていますか?
いみじくも、米国FDAが「Patient-Focused Drug Developmentに関するガイダンス」を発出し、患者にフォーカスした医薬品開発を言い出した。それを踏まえてか、ICHでも同様の「Patient-Focused Drug DevelopmentについてのReflection Paper」のパブコメを開始した*2。「何を今さら」感が無い訳ではないが、良い方向であることは間違いない。
病気、まして症状、そしてその緩和など、一番承知しているのは患者さんである。自分の身体で感じ取っている。ならば、患者さんのご意見を尊重すべきなのは当然のことだと思う。その感覚や意見を科学という力を用いてどのように医薬品開発に繋げていくか。そして規制当局としてどのように評価するか。そこが大事な点であろう。どんなに些細なことであっても、有益な情報になりうる。ならば、それらを拾いあげて新薬開発に繋げたい。
この“Patient-Focused Drug Development”、手法としては患者の声を拾い上げてBig Dataとし、それを基にAIを活用するものと思えるが、むしろ考え方自体は医薬品開発の原点回帰に思えてならない。そう思うのは筆者だけであろうか。
17. 患者さんに“優しい”医薬品開発
前項に挙げた“patient-focused”、直訳としては「患者に焦点を絞る」いうことになるが、筆者としては「患者さんに根付いた」あるいは「患者さんに軸を置いた」といった意味合いなんじゃないかと解釈する。むしろ、先述の話じゃないが、義理と人情といった日本人らしさも込めると「患者に優しい」という意味合いも入っているんじゃないか(ただしfriendlyといった、もろ感覚的な優しさではない)とさえ思っている。ハッキリ言って、どんなに患者に焦点を絞って、意見を取り入れたとしても、結果として患者が望まないのであれば使われない。あくまで患者に喜んで使って貰えるクスリを開発すること。それが目指す目的であり、意味合いなんじゃないかと。
あなたの尽力したクスリで「助かった」と思う患者さんは必ずいる。患者さんはあなたの存在さえ知らない。それでいいじゃないか。目の前で「ありがとう」と言われることだけが感謝ではない。どこかで、いつかの時点で、「治って良かった」という患者さんがいれば、それでいい。製薬会社とはそういう産業なのだから。先述の内容と合せて読者へのメッセージを贈るとすれば、以下のようになる。

18. 医薬品開発の点を線として繋げるために
医薬品開発、何となくリレー走に似ていると感じていた。少なくとも、今まではそう感じて来た。リレー走においてバトンを受ける者は後ろを見ない。医薬品開発についても同じである。見ないと言い切ってしまうとお叱りを受けそうだが、大方は見ていない。一方で、バトンを渡す者としては、次走者の後ろ姿を見て、確実にタッチする必要がある。
貴社での臨床開発部門や安全性部門は、あなたの所属するCMC部門をどれだけ振り返って見てくれていますか? 失礼な言い方とはなるが、治験薬製造を依頼するときや困ったときを除いて、彼らから歩み寄ってくることは極めて稀と言っても過言ではないのでは? 別に皮肉や嫌味を言うつもりはないが、嫌というほど経験したのも事実。貴社として社内で問題が生じていないのであれば、それでいい。ただ、もし何となく疑問を感じているのであれば、改善も踏まえた上でCMC部門としてはキチンとバトンを渡して欲しいと願う。
製造部門間ではどうか。技術移管*3など、最近は自社工場でなく、分社化したグループ内工場やCDMOといった受託製造業者に様変わりしたこともあって、一方向のバトンタッチではなく双方向に目を向けたリレーがより重要になったと考える。
ちなみに、承認後におけるリレーの場合、いわゆるサプライチェーンにおいては、渡す者と受ける者の両者が前後をシッカリと見ないといけない。そうでないとイザという際のトラブルの元となる。しかも、こちらのリレーは走者が多く、直線的ではなく多岐に亘るため複雑である。それ故に前後の確認(それこそ管理です)が物を言う。
19. 医薬品開発における品質保証
治験薬を含む開発段階に使用するモノの品質保証は重要である。“治験薬を含む”として、開発段階での治験薬以外のモノに含みを持たせているのは、本邦では「申請資料の信頼性の基準」*4と称して、GCP下での治験には用いないが申請データ取得に用いるモノを認めているからである。例えば、安定性試験データ用の検体は必ずしも「治験薬GMP基準」*5に基づく治験薬を用いる必要はない。
本Part 3では開発段階の治験薬のGMPについては取り上げないが、開発段階のデータを基に申請資料を作成すること、そのデータに信頼性を求めていること。しいては、ヒトに対する有効性・安全性のデータは治験に基づくことを考えれば、本邦においても「治験薬GMP基準」に基づいて製造・試験検査した治験薬を用いるべきであろう。申請データ限定のモノを用いた場合には、治験薬との同等性について別途に科学的データを準備せざるを得なくなることも考えれば、同一のものを使うことのほうが簡便かつ効果的と考える。ちなみに、EUや米国では、治験薬と医薬品とのGMPも申請データの信頼性も区別していない。
医薬品開発とは、あくまでモノ造り(製造業)である。と言うことは、その品質(Quality)が崩れれば、そのモノについての安全性(Safety)も有効性(Efficacy)も崩れてしまう。品質がおかしいと言うことは、そのデータに疑問があり、信頼性が置けないということでもある。それを図示すると、以下のようになる。
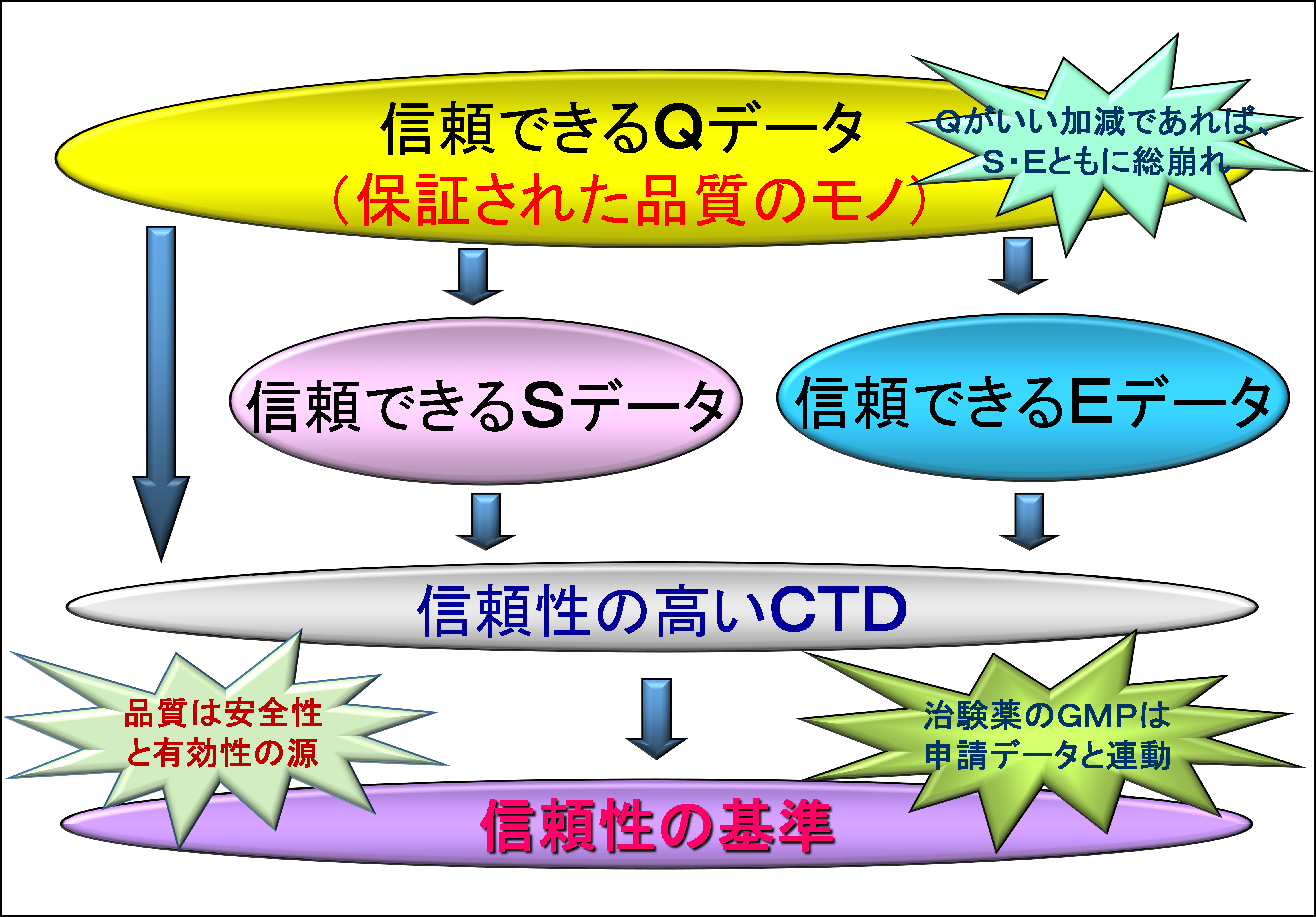
ちなみに、この関係は開発段階や治験薬に限定されるものではない。市販品であっても同様の関係にある。そういう意味では、全てのクスリに関わる者として受け止めておいて貰いたい。分かり易いように、それを以下に示す。

なお、開発段階における“治験薬のGMP”については、古田土先生の専門分野で
あり、何らかの機会に、どこかの誌面で解説して頂けたら有り難いと思う次第
である*6。
おわりに
皆さん、お気付きだろうか。この3回シリーズ「医薬品開発の点と線」の中では、「医薬品」という言葉を使っている場合もあれば、「クスリ」と言っている場合もあることを。意図的に使い分けした。堅い、正式な表現がマッチしていると判断した場合には、「医薬品」と表記し、誰にでも感覚的に馴染み易く感じさせたい場合には「クスリ」と表記した。皆さんがどのように受け取ったかは分からない。どっちでもいいじゃないと思うのであれば、それでいい。使い分けする必要もなければ、差異がある訳じゃない。言葉の響きに強弱を付けることで、感覚的でも良いので少しでも開発という作業に直接関わっていない読者の方々にも、医薬品開発の立場からのクスリに対する心情を分かって頂けたらと思っただけである。
真面目に伝えたかったことは、見えない、知らない患者さんがどこかにいて、その患者さんのためのクスリを創ろう、造ろう、そして直接的・間接的にサポートしようと頑張っている自分がいる。患者さんからは見えなくたっていい。が、自分はあなたを見ているよ、という想いを込めて業務に取り組んで欲しい。GMPだって、GQPだって、GDPだって、その他の法規制だって、全て患者さんのためにあるんだということを忘れてはいけない。クスリに関わるんだったら、ヒトとして恥じることなく、胸を張れるように仕事をして貰いたいと願う。
では、また。See you next time on the WEB.
【徒然後記】
おうち時間の過ごし方:無駄なウゴキと無駄なアガキ
皆さんはどうだろうか。新型コロナウイルスのため、おうち時間が多くなったんじゃないでしょうか。私の場合、元々がオタク系、少なくともアウトドア派ではない。そのため、今まで以上におうち時間が多くなってしまった。過去に両足を交通事故で痛めたこともあり、ある程度の運動、特に散歩が必要と分かっているのだが、横着な性格のせいか、外出するのが嫌。せめてもの運動(自分でそう言い聞かせているだけ)として、家事を含む家の中での作業に無駄な動きを取り入れる。特に階段の上り下り。1回で纏めれば済むものを数回に分けて運ぶといったこと。掃除でも意図的に余計な力を入れたり、不要な部位の筋肉を使う。自分ではそれなりの運動になっていると期待する。確かに、無駄な動きや力を入れると、翌日 or 翌々日にそれなりに筋肉痛が(単に歳のせいか・・・)。ただそれも数年前から老化速度に負けていると気づき、出社のない日はストレッチを始めた。たまたま昨年3月末で退職。その直後に1度目の緊急事態宣言が発令され外出自粛。こうなればと一大奮起してストレッチ時間を延長。それまで約1時間だったのを1.5時間に。お蔭で体調は良いと言える。ただ、歳をとると筋肉痛が遅れて発生するだけでなく、なかなか緩和しない。毎日筋肉痛が残ったまま、ウゥーーーと唸りながらのストレッチ。足の調子云々以前に、ハッキリ言って、完全な“自虐性ドM”と化した。
--------------------------------------------------------------------------------------
*1:「保管温度逸脱許容時間」と訳されることが多いようであるが、保管・輸送の各プロセスに割り振られた、規定温度範囲外(温度逸脱)に曝されても品質に影響を及ぼさない許容可能な温度範囲と時間のことである。治験薬の場合は治験薬製造施設から治験施設までの、市販品の場合は製造所から病院・調剤薬局までの積算時間+バッファー時間により算出する。
*2:“Patient Focused Drug Development”については、下記のGMP Platformトピックスを参照のこと。
・2020年12月8日付GMP Platformトピック「ICH/Reflection Paper on Patient-Focused Drug Development for public consultation」
・2020年7月21日付GMP Platformトピック「米国FDA/CDER Patient-Focused Drug Development」
・2020年6月17日付GMP Platformトピック「米国FDA/Patient-Focused Drug Development: Collecting Comprehensive and Representative Inputに関する最終ガイダンス発出」
・2020年12月8日付GMP Platformトピック「ICH/Reflection Paper on Patient-Focused Drug Development for public consultation」
・2020年7月21日付GMP Platformトピック「米国FDA/CDER Patient-Focused Drug Development」
・2020年6月17日付GMP Platformトピック「米国FDA/Patient-Focused Drug Development: Collecting Comprehensive and Representative Inputに関する最終ガイダンス発出」
*3:“Technology Transfer”は技術移転と訳されることが多いと思うが、個人的には技術移管の表現のほうが好きである。理由は、GMPも含めての品質の管理込みで移す(渡す)というニュアンスが濃いからである。ちなみに、技術という言葉から“Technical”と誤解され易いが、あくまで“Technology”のtransferである。その言葉通り、技術としてのテクニックだけでなく、そこには論理や意図といった“ology”が含まれていなければならない。
*4:昭和36年2月1日 厚生省令第1号(最終改正:平成30年3月23日厚生労働省令第34号)薬機法施行規則第43条(申請資料の信頼性の基準)
https://elaws.e-gov.go.jp/search/elawsSearch/elaws_search/lsg0500/detail?lawId=336M50000100001#B
https://elaws.e-gov.go.jp/search/elawsSearch/elaws_search/lsg0500/detail?lawId=336M50000100001#B
*5:詳細については、『古田土真一 著、「治験薬GMPハンドブック」、じほう、2009年』を参照のこと。
*6:古田土先生によると、上記著書発刊以降の2009年から2019年の10年間の世界的な“治験薬のGMP”の動向について、一般社団法人 製剤機械技術学会による「製剤機械技術ハンドブック オンライン版 7.3 治験薬の品質保証」(2020年10月16日更新)に整理したとのことである。会員限定とはなるが、会員であればIDおよびPWによりアクセスもダウンロードも可能であるとのことである。


コメント
/
/
/
コメント