再生医療等製品の品質保証についての雑感【第20回】
2020/12/11
再生医療

はじめに
本稿でも、引き続き、再生医療等製品製造の無菌操作環境にて生じるリスクの考え方として、環境モニタリングと微生物迅速試験法の採用について、雑感を述べさせていただきます。
● チェンジオーバーにおける無菌操作環境維持の条件
GCTP省令の適合確認においては、無菌性に関わる品質構築が最も大切な要素です。生きた細胞を最終加工物とする再生医療等製品は、最終滅菌法ではなく、無菌製造法(無菌操作の実施)による無菌性の確保が要求されます。無菌操作は、以前(第17回)に述べた細胞製造の特性より、原料から出荷(最終加工物)まで、全工程を通しての無菌操作の実施が必要です。このとき、現在の主流である容器を開放して細胞加工操作を行う工程群では、構造設備とその運用により構築される無菌操作環境、すなわち無菌操作等区域(グレードA)とその設置区域である清浄度管理区域(グレードBあるいはそれ以下の清浄度レベル)の運用は、数週~数ヶ月の比較的長期間にわたり、継続的に維持する運用が必要となります。
経産省の「チェンジオーバーに関するガイドライン2019」では、図1のように、清浄度レベルが管理値の範囲内で制御できていることを前提に、異物混入による次工程への影響を評価し、適切な清浄化の手順構築を提示しています。一方で、無菌操作環境の評価方法には言及しておらず、従来の環境モニタリング手順(培養法)では結果が出るまでに遅延が生じるため、再生医療等製品製造に適した迅速試験法による評価手順の採用が言外で期待されていると考えます。
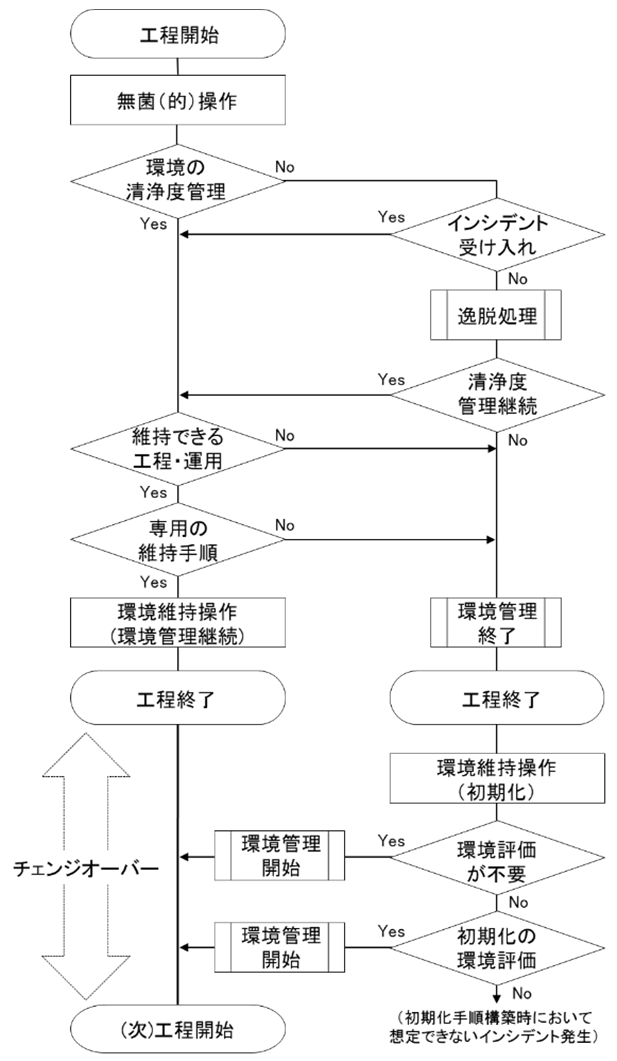
図1. 工程運用時における無菌操作環境の管理フロー(経産省ガイドラインより引用)
本稿でも、引き続き、再生医療等製品製造の無菌操作環境にて生じるリスクの考え方として、環境モニタリングと微生物迅速試験法の採用について、雑感を述べさせていただきます。
● チェンジオーバーにおける無菌操作環境維持の条件
GCTP省令の適合確認においては、無菌性に関わる品質構築が最も大切な要素です。生きた細胞を最終加工物とする再生医療等製品は、最終滅菌法ではなく、無菌製造法(無菌操作の実施)による無菌性の確保が要求されます。無菌操作は、以前(第17回)に述べた細胞製造の特性より、原料から出荷(最終加工物)まで、全工程を通しての無菌操作の実施が必要です。このとき、現在の主流である容器を開放して細胞加工操作を行う工程群では、構造設備とその運用により構築される無菌操作環境、すなわち無菌操作等区域(グレードA)とその設置区域である清浄度管理区域(グレードBあるいはそれ以下の清浄度レベル)の運用は、数週~数ヶ月の比較的長期間にわたり、継続的に維持する運用が必要となります。
経産省の「チェンジオーバーに関するガイドライン2019」では、図1のように、清浄度レベルが管理値の範囲内で制御できていることを前提に、異物混入による次工程への影響を評価し、適切な清浄化の手順構築を提示しています。一方で、無菌操作環境の評価方法には言及しておらず、従来の環境モニタリング手順(培養法)では結果が出るまでに遅延が生じるため、再生医療等製品製造に適した迅速試験法による評価手順の採用が言外で期待されていると考えます。

図1. 工程運用時における無菌操作環境の管理フロー(経産省ガイドラインより引用)
2ページ中 1ページ目













コメント
/
/
/
この記事へのコメントはありません。
コメント