GMP Auditor育成プログラム
・監査対象の外部製造所が多すぎて、人が足りない
・実地監査にて、どこを観るのか?何を聞くのか?ポイントを知りたい
・外部製造所との今後の委託も踏まえ良い関係を続けつつ、継続的改善を求めたい
このようなお悩みに応えるため、GMP Platformの知を結集し、日本の製薬企業向けの体系的なGMP Auditor育成プログラムを提供いたします。
講演者
 平島 俊一 株式会社シーエムプラス 取締役会長
平島 俊一 株式会社シーエムプラス 取締役会長
1980年藤沢薬品工業株式会社(現アステラス製薬株式会社)入社以来の約37年間にわたり医薬品の生産および品質保証関係の業務に従事。この間、アステラスファーマテック株式会社代表取締役社長を務め、国内グループ生産工場の安定稼働を図り、また、アステラス製薬株式会社グローバル品質保証機能長として日米欧3極の品質部門を統括する。医薬品製造に関係する種々多様なマネージメント経験を有している。2017年1月株式会社シーエムプラス入社。2018年4月常務取締役に就任。2020年7月より取締役副社長、2025年7月より取締役会長。
 下条 芳敬 株式会社シーエムプラス シニアコンサルタント
下条 芳敬 株式会社シーエムプラス シニアコンサルタント
1989年 藤沢薬品工業(現アステラス製薬)に入社、抗生物質原薬の研究開発・工業化検討・技術移管業務等に従事。2002年から治験薬コーディネーション業務を担当(2006~2008は米国子会社出向)。2013年から品質保証業務に従事、グローバル機能の監査責任者も務め、約200件のGMP/GDP監査や内部品質監査を担当。2022年11月にシーエムプラス入社。
 田中 良一 株式会社シーエムプラス シニアコンサルタント
田中 良一 株式会社シーエムプラス シニアコンサルタント
2006年に京都府に入庁、2009年から健康福祉部薬務課に勤務。その後、厚生労働省監麻課GMP指導官(2018~2020)として無通告調査を実施、京都府帰庁後は薬事支援センターの立ち上げに尽力し、改善相談対応、研修等を実施。2024年にシーエムプラス入社、医薬品、化粧品等のGxPおよび医療機器QMSのコンサルティングを担当。
 森川 美千代 株式会社シーエムプラス シニアコンサルタント
森川 美千代 株式会社シーエムプラス シニアコンサルタント
1989年 テルモ株式会社へ入社、栄養食品の研究開発に従事。1991年に品質保証課へ異動、注射剤、透析用剤、医療機器、コンビネーション製品、流動食の品質管理及び薬事業務を担当。2008年より品質保証部門にてGMP、QMSに関する業務に従事。FDA査察対応、コンビネーション製品のためのISO13485及びMDSAP認証取得。PDA製薬学会メディカルデバイス委員会及びQAQC委員会所属、プレフィルドシリンジセミナー実行委員メンバー。2024年7月にシーエムプラス入社
 高橋 治 株式会社シーエムプラス シニアコンサルタント 工学博士
高橋 治 株式会社シーエムプラス シニアコンサルタント 工学博士
1987年日本鉱業(現ENEOS)入社、治験薬GMP体制の立ち上げ、化学合成原薬の製法開発等に従事。2002年以降、住友製薬(現住友ファーマ)、持田製薬、ノバルティスファーマで品質保証部門に勤務、品質監査を含むGQP業務を担当。2013年9月にシーエムプラス入社、2014年4月に欧州化学工業連盟原薬委員会の監査員認定を取得。
日程
2026年3月11日 (水) ~ 3月13日 (金)
受講形式
オフライン
開催場所
神奈川産業振興センター 13階会議室
開催概要
■ 集合研修日時
2026年 3月11日(水) 10:00 - 19:00
2026年 3月12日(木) 9:00 - 18:00
2026年 3月13日(金) 9:00 - 16:30
■ 受講費用
285,000円(税抜) ※下記の費用を含みます。
1. 集合研修3日間受講費用
2. eラーニング 受講費用
※『GMP-eTutor:GMP中級コース』、もしくは
『QCD+:GMDP+継続的教育訓練』のいずれかを既に
受講済みの場合は受講費用から40,000円(税抜)を割引します。
3. 集合研修中の 昼食
4. 各種配布物
- 集合研修教材
-『PIC/S GMP Guide Part I』対訳・解説ハンドブック
-『PIC/S GMP Guide Part II』対訳・解説ハンドブック
-修了証(効果確認テスト・eラーニング合格者のみ)
※ 宿泊が必要な方は、ご自身での宿泊施設確保をお願いいたします
■ 定員 20名
■ 締切日 2026年2月25日(水)
■ 変更・キャンセルについて
申込後、ご都合により集合研修セミナーに出席できなくなった場合は代理の方がご出席下さい。
代理者の調整がつかず欠席される場合事務局までご連絡下さい。
以下の規定に基づき、料金を申し受けます。
土日、祝祭日を除き、集合研修セミナー開催4日前以降の欠席連絡:受講料の 100%
また、eラーニング利用開始後のキャンセルの場合、eラーニング利用料の全額を頂戴します。
■ 開催趣旨
製造販売業者による監査が義務化されて以降、後発医薬品の普及等でその重要性は増し、さらには、昨今の品質問題から、令和4年の品質管理運用通知では、コミュニケーションを重視した実効性ある監査が、原則、実地で求められてきました。そして令和7年の薬機法改正では、この管理監督義務が法律本体へと格上げされ、企業の責任は格段に重くなっています。加えて、改正GMP省令では、新たに製造業者としても供給者への管理監督義務が発生しており、監査の重要性は増す一方です。こうした背景から、製造販売業者・製造業者ともに専門性を備えた監査員(Auditor)の確保が、多くの企業にとって喫緊の課題となっています。
そのような課題解決のために、シーエムプラスでは、GMPを網羅的に学習できるeラーニングと3日間の集合研修による製薬企業向けの体系的な教育プログラムを提供いたします。
■ プログラムのPoint

■ 資料のダウンロード
eラーニング Auditor育成コース 講座一覧 (PDF/約426KB)
GMP Auditor育成プログラム パンフレット (PDF/約9MB)
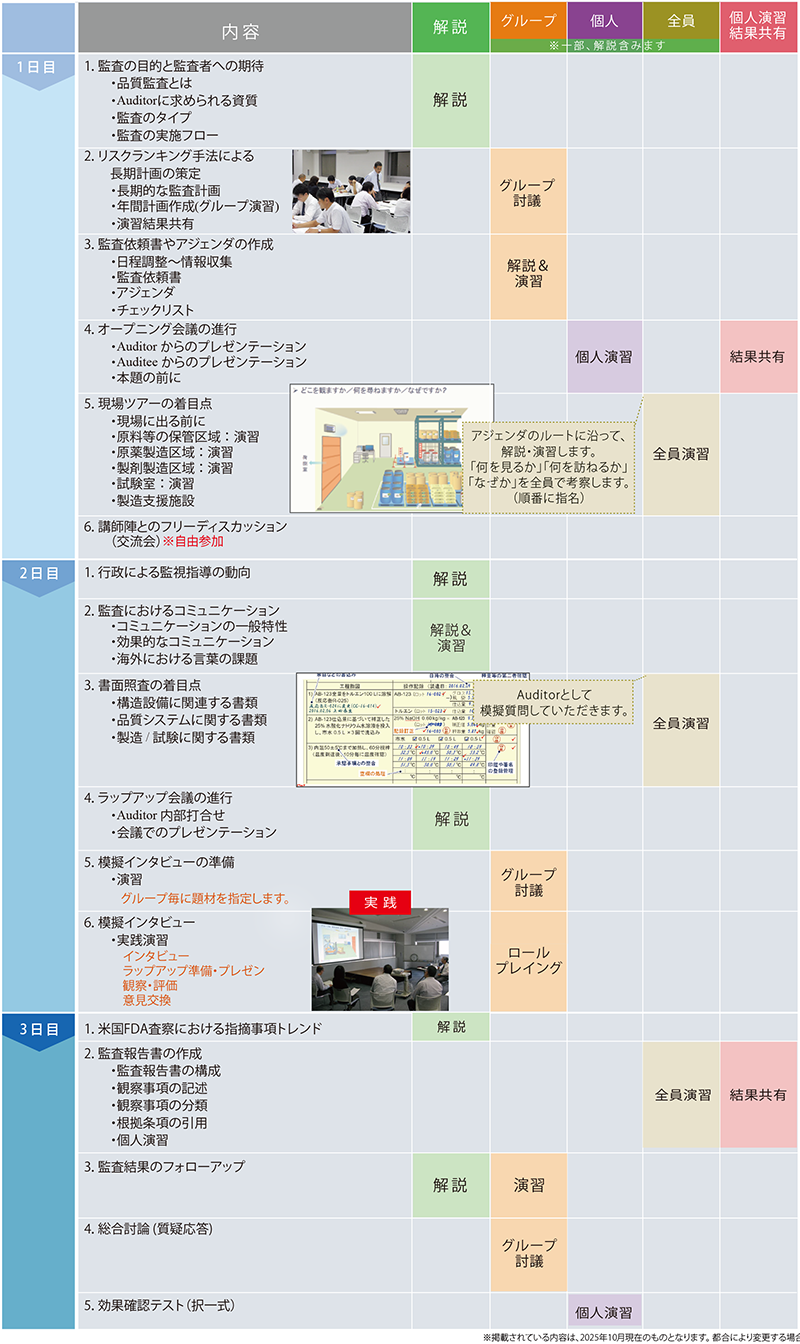
■ 集合研修内容
※現在お申し込みのお手続き、および書類送付についてはすべてeメール/添付での対応となります



