≪解説≫2025年 改正薬機法【第7回】

品質保証・安定供給・創薬環境の変革に対して企業として備えるべきこと
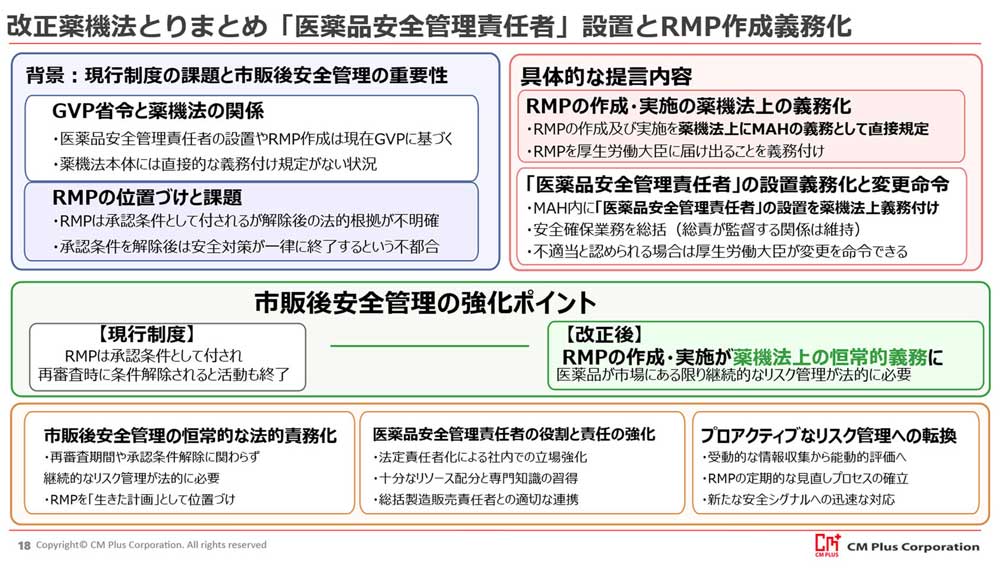
【第7回】改正薬機法の主要なポイントと実務への影響(その2)
(前回からの続き)
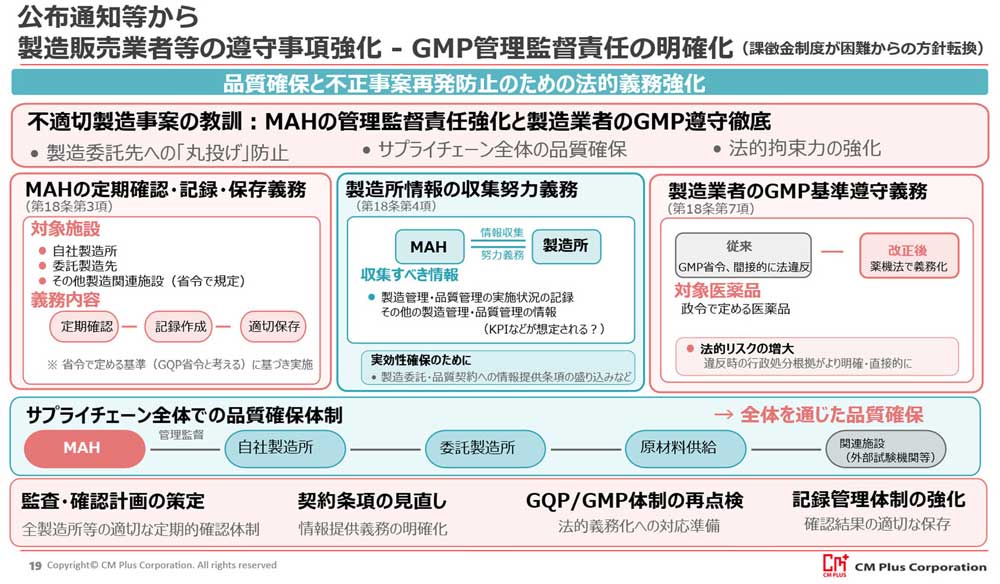
(2)MAH、製造業者(工場)のGMP遵守関連の規制強化
- MAHによる製造所管理監督責任の強化
- 医薬品のMAHは、製造所等の製造管理・品質管理が適正に行われているかを定期的に確認し、記録・保存することが薬機法上の義務となります。また、製造所等からの関連情報の収集も薬機法上の努力義務とされます。
- これまでもGQP省令を中心にMAHによる管理監督責任はありましたが、いわゆる「製造委託先への丸投げ」は許されず、MAHが自社製造販売品の品質に対して最終的な責任を負うことの具体的な行動として法的に求めることとされます。
- 今後も引き続き製造所等との取決めの適切な見直しや、監査体制の維持や必要に応じて強化やリスクベースによる対応が必要です。単なる形式的な監査ではなく、実効性のある管理監督が問われると考えられす。
- 製造業者のGMP基準遵守の直接義務化
- これまでGMP省令違反は、薬機法上の直接的な違反と捉えられる規定は存在していませんでしたが、GMP省令の基準遵守義務が薬機法上に規定されます 。
- これは、GMP違反に対する行政処分の根拠をより明確にし、抑止力を高めるための重要な変更と考えます。また、課徴金制度のGMP違反への適用が見送られた代替措置としての意味合いも持つため、行政の強い意志の表れと捉えることが妥当でしょう。
- 製造業者は、GMP遵守がより直接的な法的義務となったことを認識し、コンプライアンス体制を一層徹底する必要があります。


コメント
/
/
/
コメント