再生医療等製品の品質保証についての雑感【第80回】

第80回:細胞製造の品質マネジメントシステム (10)
~ 製造環境(構造設備)の設計で大事なもの (4) ~
はじめに
今回からは、構造設備設計の適格性評価、特に設計時適格性評価(DQ)についてのお話しとなります。
前回のユーザー要求仕様(URS)のお話しにおいて、URSの基本要求事項は網羅的に示す必要があることを述べました。対してDQでは、構造設備/機器を設計し、準備する必要があるので、シンプルかつ具体的に項目を示す必要があります。
● 適格性評価の位置づけ
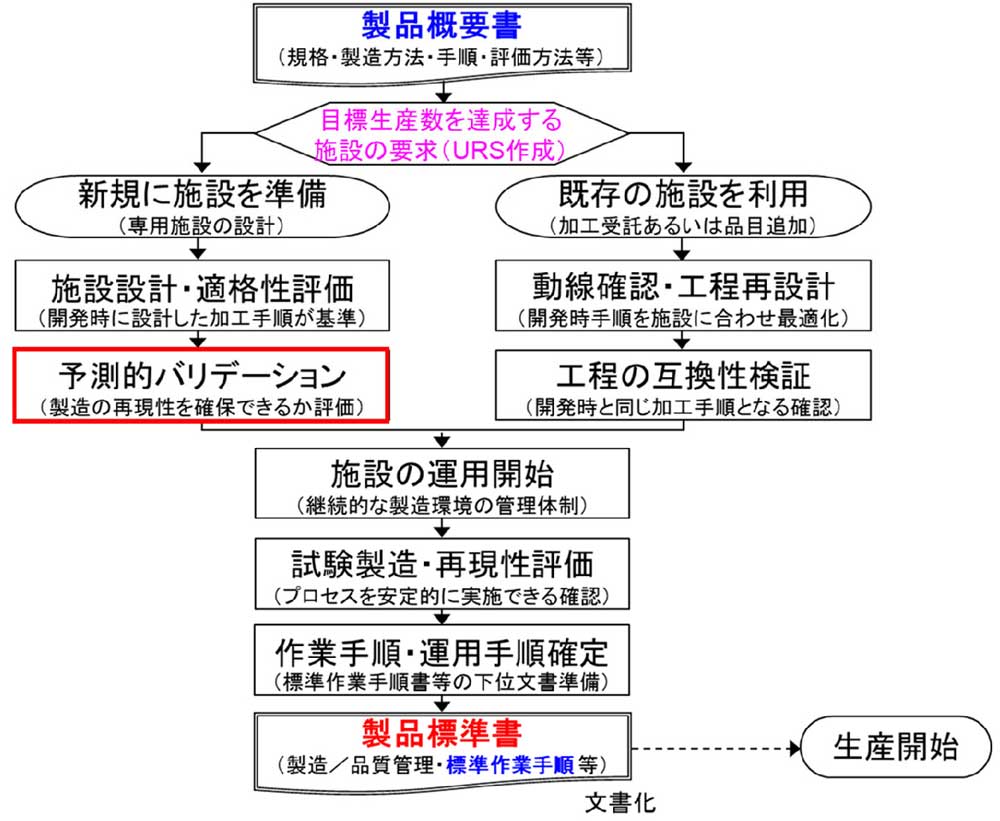
細胞加工製品製造の工程開発における、GMP基準適格性評価では、原則として、下図の左ルートのように、「新規に施設を準備」することが前提と認識します。適格性評価は、そもそも、特定製品の規格、製造手順および必要な生産数が明確になった後に実施しなければ全ての目標を満たすのが困難です。先に構造設備を行った場合、GMPに適合させるには、工程の互換性検証、すなわち再DQ時において、必ず、「妥協」が必要になります。
● 適格性評価におけるDQとは
あらためて、適格性評価とは、プロセスバリデーションにおいて、実施する手順や環境が、再現良く要求を達成できる信頼性保証を行うための活動です。正しくURSを作成し、その要求に準じた仕様が満たされれば、製品の通常生産前に、製造工程の妥当性が確保できる、「予測」ができるようになります。すなわち、予測的バリデーション(薬機法では通常生産前に行うバリデーションと定義される)が達成されます。
では、「予測」はいつできるようになるのでしょうか。


コメント
/
/
/
コメント