GMPヒューマンエラー防止のための文書管理【第92回】

サイトQA(品質保証部門)
1.品質システムにおけるリスクマネジメント
GMP省令の各条文にサイトQA部署が係わっている。サイトQA部署だけではできるわけではない。その業務のほとんどが製造部門やQC部署の作業結果等の確認や承認である。確認にしろ、承認にしろ、その内容を理解し、評価せねばならない。サイトQA業務は、製造所としてのほとんどのGMP活動に係るといっても過言ではない。
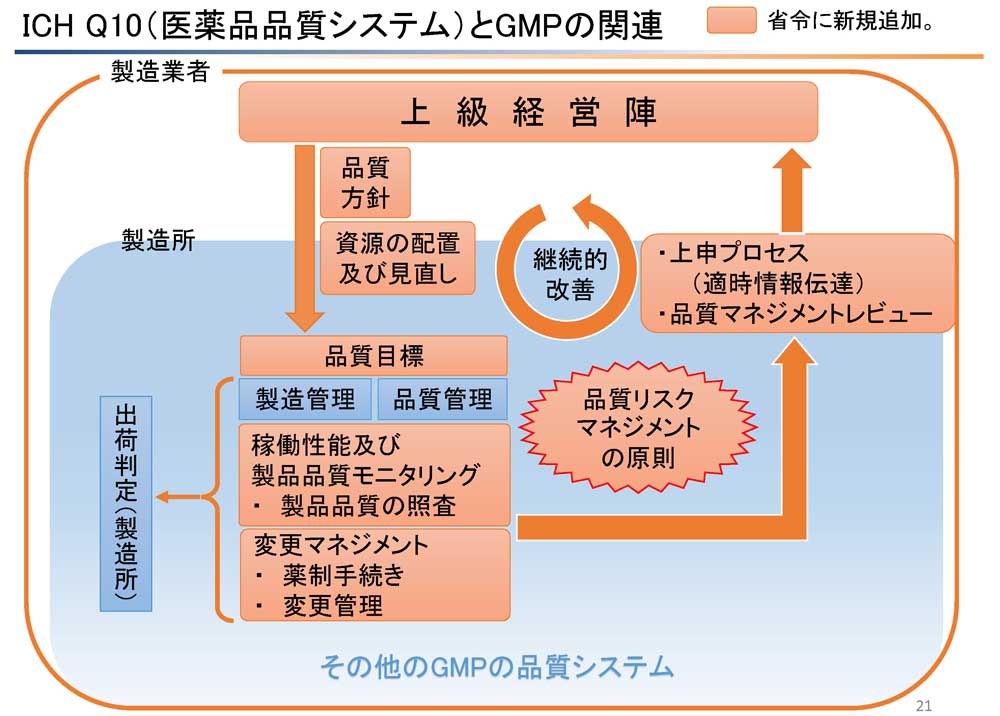
サイトQAが継続的改善のサイクルの要となる。品質目標、稼働性能及び製品品質モニタリングとしての製品品質の照査、変更マネジメント等、医薬品品質システム要素となるシステムを担う部署こそがサイトQAである。GMP違反事例の多くが、サイトQA部署が適切に活動できておらず、引き起こされた。再度、GMP省令が改正されたこのタイミングで、製造所におけるサイトQAの位置づけと役割を検討して、適正なQA活動の徹底を図るべきである。サイトQAが行うチェックが十分機能しなければ、GMP違反となるだけでなく、品質に不安がある製品を市場へ送り出すことになり、医療機関や患者を不安にさせることになる。変更管理や逸脱管理の記録には、サイトQAが行った評価の判定が記載されている。しかし、その根拠が不明慮のケースをよく見かける。査察や監査において、なぜその評価結果になったかを尋ねても、明快な回答がされず、その評価結果の信頼性を疑わざるを得ないケースとなる。当局の指摘事項でも、最近は、その評価結果の根拠を求めていることが多くなっている。サイトQAは、安易な評価をせず、ぜひ、その評価を行ったかの根拠を明確にし、記録することが必要である。評価の根拠とは、リスク分析や低減策の実施結果やバリデーション結果、教育訓練の実効性評価、変更後の評価、CAPAの有効性確認である。これらの根拠を示すことで、その評価結果に信ぴょう性が増し、データインテグリティが確保できたことになる。サイトQA業務の記録に、その評価結果に至ったかを記載しなければならない。しかし、その経過たる記録はバリデーションや教育訓練、変更管理、CAPAの記録とダブルの必要はなく、それぞれの記録と適切にトレースされていれば十分である。記録についてデータインテグリティとして、内容だけでなく、その日付、発信者、宛先などを適切に管理できるようにし、重複を避け、効率的な管理をしなければならない。
2.サイトQA業務
GMP省令で求められるサイトQA(品質保証部門)業務は次のとおりである。


コメント
/
/
/
コメント