FDA査察トレンド(FY2020-2024)

本稿では、近年のFDA(米国食品医薬品局)による査察戦略の変遷と、直近のデータに基づく指摘事項のトレンドについて概説します。特に、日本国内の製薬企業に対して発出されたForm 483(査察観察事項)の具体的な指摘事例を紹介し、その傾向を分析し、査察準備における優先課題を考察します。
1. FDA査察戦略の変遷と現状
コロナ禍において、FDAは「ミッションクリティカル」な査察に資源を集中させるとともに、新たなアプローチや技術を導入してきました。パンデミック収束後、オンサイト査察は本格的に再開・活発化していますが、コロナ禍で試行された以下のアプローチは、必要に応じて現在も継続・適用されています。
- リスクベースでの査察スケジューリング
査察先のロケーション、過去の査察履歴、製品・プロセスの特性等を総合的に考慮し、リスクに応じた査察頻度や派遣する査察官の人数が決定されています。 - 相互認証制度(MRA)の積極的活用
他国の規制当局が実施した査察情報や指摘事項を、FDAが積極的に活用する動きが進んでいます。 - 海外施設に対する無通告査察の拡大
インドや中国を中心に、事前の通告なしに行う「無通告査察」の運用が開始されています。日本国内においても、条件が整えば近い将来実施される可能性があるため、留意が必要です。
現在、FDAによるオンサイト査察は活発化の一途を辿っており、米国へ医薬品を輸出している日本企業においては、平時からの十分な備えと迅速な対応体制の構築が不可欠となっています。
2. 指摘事項のグローバルトレンド(FY2020-2024)
FDAの現在の関心事項や考え方を把握するためには、Warning Letter(警告書)およびForm 483における指摘事項の傾向分析が有効です。
2.1. 全体トレンド:Warning Letterにおける指摘事項
FY2020からFY2024の間に発出されたWarning Letterにおいて、指摘件数が多かった項目は以下の通りです。バリデーション、試験室管理や、品質部門(QCU)の責任に関する指摘が上位を占めています。

2.2. 全体トレンド:Form 483における指摘事項
同期間のForm 483においては、OOS調査や品質部門(QCU)の責任に関する指摘が圧倒的に多くなっています。

2.3. 国内企業特有のForm 483指摘トレンド
医薬品GMDPコンサルティングを行うシーエムプラスが独自に収集・分析したデータによると、FY2020~2024の5年間で延べ107社の国内企業がFDA査察を受け、そのうち約6割にあたる64社でForm 483が発出されました。詳細情報が入手できた45社(総計183件の観察事項)の分析から、日本企業特有の課題が浮き彫りになっています。
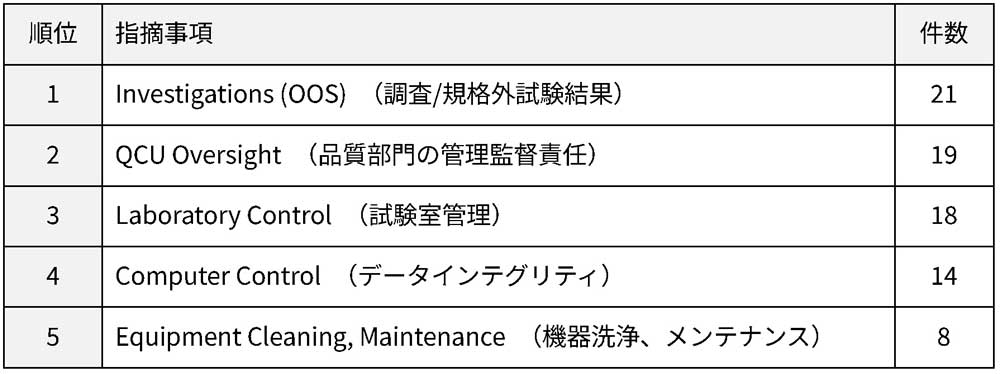
国内企業においても、OOS調査への指摘が最多であるほか、品質管理部門(QCU)の管理監督責任やデータインテグリティに関する指摘が目立つ傾向にあります。
3. 品質管理部門(QCU)関連の具体的な指摘事例


コメント
/
/
/
コメント