ラボにおけるERESとCSV【第130回】

FDA 483におけるデータインテグリティ指摘(100)
7.483における指摘(国内)
前回より引き続き、国内企業に対するFDA 483に記載されたデータインテグリティ観察所見(Observation)の概要を紹介する。
■ FFFFF社 2023/11/10
施設:原薬工場
■ Observation 1
装置洗浄の手順が規定されておらず、装置洗浄に引き続きなされる中間体製造における装置使用許可の手順も規定されていなかった。特に、
中間体の新しい洗浄手順が科学的合理性なく規定されており、以下の評価がなされていない。
装置洗浄の手順が規定されておらず、装置洗浄に引き続きなされる中間体製造における装置使用許可の手順も規定されていなかった。特に、
中間体の新しい洗浄手順が科学的合理性なく規定されており、以下の評価がなされていない。
• 洗浄バリデーションもしくは洗浄ベリフィケーションの必要性
• 使用前の装置保護
• 使用直前の装置清浄度
★解説
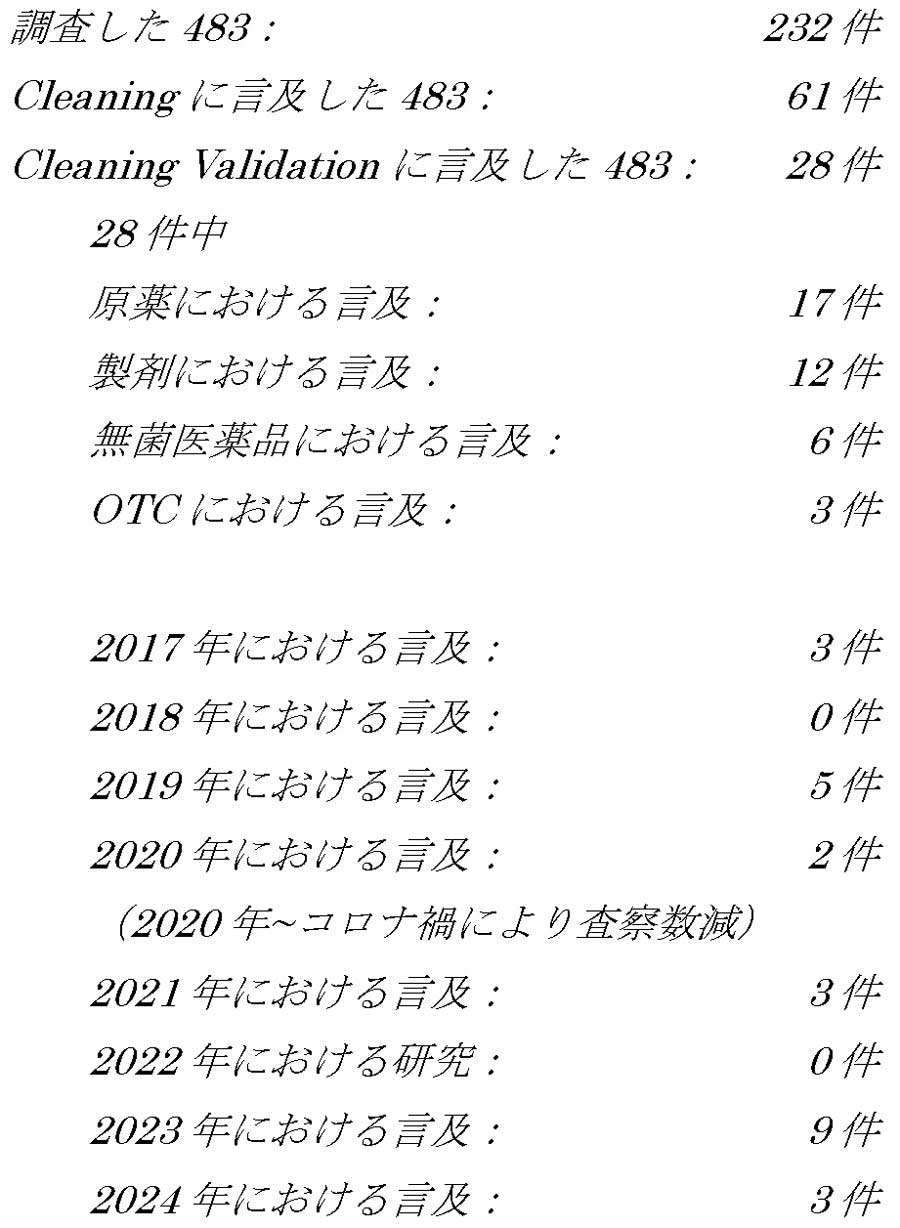
FDA OOSガイダンスの抜粋概要連載128回において「国内外のFDA査察において洗浄バリデーション(Cleaning Validation)の指摘が増加しているように感じる」と記載した。筆者が本稿執筆時に所有していたFDA国内査察における232件の483に対し、洗浄バリデーション指摘の確認を行った。医薬品の品質保証において洗浄バリデーションは非常に重要であるので、データインテグリティやCSVの指摘ではないが、その確認結果の概要を以下に紹介する。(詳細は表130-1を参照)


コメント
/
/
/
コメント