医薬品業界におけるニトロソアミン対策と新たな「環境制御」ソリューション ~製造環境からの包括的アプローチ~

記事投稿:日本無機株式会社 【PR記事】 (2025.12.1 更新)
医薬品業界におけるニトロソアミン対策と新たな「環境制御」ソリューション
~製造環境からの包括的アプローチ~
1.医薬品業界におけるニトロソアミン課題
規制強化の背景と経緯
近年、医薬品中において、発がん性が懸念されるニトロソアミン類(例:N ニトロソジメチルアミン(NDMA)や N ニトロソジエチルアミン(NDEA))が検出され、世界各国で医薬品の自主回収や製造販売業者への点検要請が実施されました。例えば欧州では 2018 年に降圧薬(サルタン系)において原薬中NDMAが発見された事件が契機となりました。 厚生労働省+2European Medicines Agency (EMA)+2 また、米国の U.S. Food & Drug Administration(FDA)も「Information About Nitrosamine Impurities in Medications」にて、ニトロソアミン類が長期にわたり許容レベルを超えて医薬品中にあると発がんリスクが増す可能性があると明記しています。 U.S. Food and Drug Administration+1
日本においても、厚生労働省・医薬品医療機器総合機構(PMDA)が「医薬品におけるニトロソアミン類の混入リスクに関する自主点検」通知を令和3年10月8日に発出し、製造販売業者に対してリスク評価・管理を求めています。 厚生労働省 さらに、2025年7月には「医薬品におけるニトロソアミン類の混入リスクに関する自主点検後の対応について」が厚生労働省から発表されています。厚生労働省
このように、世界的な規制強化/監視強化の流れが、医薬品製造現場におけるニトロソアミン類管理を一層重要なものとしています。
ニトロソアミン不純物が医薬品製造で問題となる理由
ニトロソアミン類は構造的に発がん性を持つ可能性がある化合物群で、動物実験などにおいてがん誘発性を示すものもあります。例えば、レビュー論文では「医薬品中のニトロソアミン不純物は人体の安全性にとって懸念され得る」と記されています。 PubMed+2
FDAのガイダンスでは、「低レベルであれば即座に人体に害を与えるものではないが、許容摂取量を超えて長期間にわたり曝露されるとリスクがある」としています。 U.S. Food and Drug Administration
また、日本の厚生労働省の資料にも、ニトロソアミン類を「医薬品中に混入する可能性のあるリスク物質」と位置付け、製造・包装・保管といった工程全体の管理を求めています。 厚生労働省+1
製造工程内で生じる副反応、交差汚染、包装資材や保存条件による生成などが混入の原因として挙げられており、医薬品の品質・安全性を維持する上で大きな課題となっています。 厚生労働省
規制対応が求められる医薬品例
実際にニトロソアミン類混入が報告された医薬品としては、
・サルタン系降圧薬(ARB:アンジオテンシンII受容体拮抗薬) European Medicines Agency (EMA)+1
・胃薬・消化性潰瘍治療薬(例:ラニチジン、ニザチジン) 厚生労働省+1
などがあり、医薬品製造業界ではこれらの対応事例を参考に、自社品目のリスク評価・対策強化が進んでいます。
2.製薬メーカーが直面する課題
ニトロソアミン混入の主な原因
厚生労働省の通知資料や学術論文では、医薬品製造/包装/保管工程におけるニトロソアミン類混入の要因として以下のような項目が指摘されています。 厚生労働省+1
・合成過程での副反応(アミン+ニトロ化剤由来反応) ACS Publications
・共用設備による交差汚染(前工程品・別製品由来の汚染) 厚生労働省+1
・使用する溶媒・試薬・添加剤または包装資材中の不純物(亜硝酸イオンなど)による混入 biotech-asia.org+1
・包装資材・保存条件(高温・湿度・長期保存)による生成や分解反応進行 PMC
このように、製造・包装・保管という「製薬プロセス全体」がリスク領域であり、単一の対策で片付くものではありません。
従来の対策の限界
多くの製薬メーカーが製造方法の見直し(反応条件変更・使用原料変更)、設備更新、設備専用化を実施しています。しかしながら、これらには多大なコスト・時間・設備停止リスクを伴い、特に既存製造ラインを抱える中堅・大手メーカーにとっては容易ではありません。厚生労働省の資料でも、「全ての対象医薬品に対してリスク低減措置を強化する必要がある」としながらも、「製造工程変更・設備更新には限界がある」と指摘されています。厚生労働省
また、学術的レビューでも「ニトロソアミン検出限界が非常に低いため、検査装置・分析手法の高度化も並行して必要であり、対策のハードルが高い」と言われています。 PubMed+1
したがって、製薬メーカーは「製造工程そのものだけでなく、環境・設備・保管条件・空気質」も含む総合的な対策を検討せざるを得ない状況にあります。
3.ニトロソアミン関連リスクを低減する新たな「環境制御」
技術的特徴と優位性
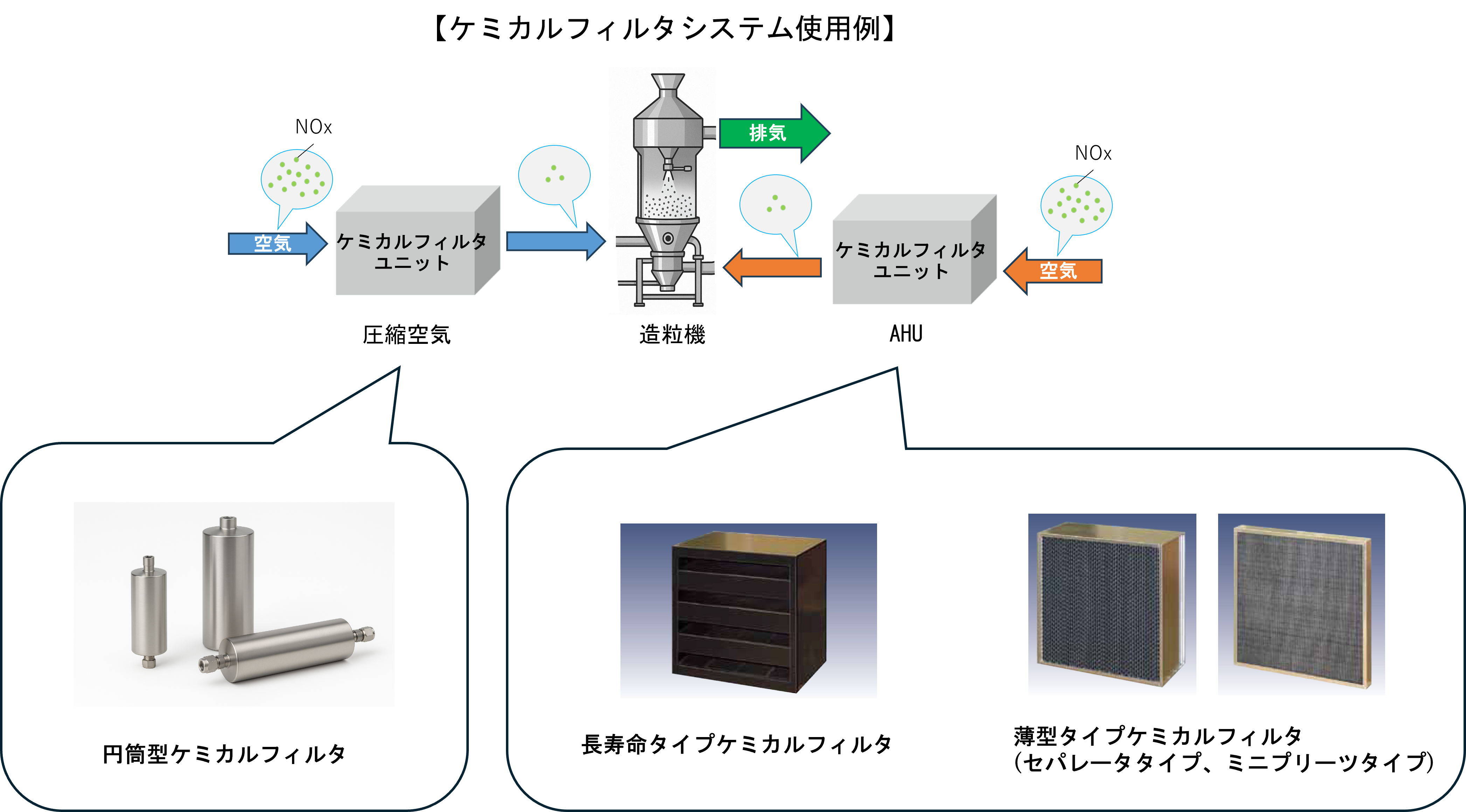
日本無機株式会社は、製造環境における空気中の NOx(窒素酸化物)をターゲットにした「NOx除去ケミカルシステム」を開発・提供しています。
主な技術的な特徴は以下です。
- 長年にわたり電子・半導体企業向けに研究・開発・販売してきたケミカルフィルタのノウハウをもとに、空気中の NOx を効率的に除去。
- ベースとなる基材(活性炭など)に特殊添着剤を付与し、NOx(およびそれに起因する二次反応物)を吸着/分解可能。
- 長寿命設計かつ既存クリーンルーム・ブース・造粒・コーティング設備への後付け適用が可能。
空気環境改善により、原薬/製剤の製造/保管工程におけるニトロソアミン関連リスクを低減する新たな「環境制御」ソリューションとして位置付けられている。
(参照:URLおよびカタログ:IVEXL サービス詳細ページ、技術カタログ)
出典:IVEXL サービス詳細ページ、技術カタログ(日本無機)
適用プロセスと効果領域
このシステムは、特に以下のような工程・設備での適用が有効とされています。
- クリーンブース(医薬品製造環境における空気管理)
- 造粒・乾燥・コーティング工程(製剤製造時に空気/雰囲気の影響を受けるプロセス)
- 保管・包装工程においても、空気中NOx・湿度・温度が反応を促す条件となるため、適用可能
このように、製造/包装/保管というプロセス全体をカバーすることで、既存製造設備の大規模改修や専用設備構築に代わる、環境制御ソリューションとしての優位性があります。
4.検証事例と具体的成果
規制要件を満たすための有効な手段としての位置づけ
各国規制機関は、ニトロソアミン類に対して「許容摂取量(Acceptable Intake, AI)」を設け、製造販売業者に対してリスク評価・分析・改善措置を要求しています。例えば、FDAは「Control of Nitrosamine Impurities in Human Drugs」というガイダンスを発表し、APIおよび製剤におけるニトロソアミン類のリスク管理を明記しています。 U.S. Food and Drug Administration
また、欧州の European Medicines Agency(EMA)も「Nitrosamine impurities in human medicines」として、サルタン系・ラニチジン等に関するレビューを発表しています。 European Medicines Agency (EMA)+1
こうした中で、日本無機の NOx除去システムは「製造環境起点」のリスク低減策として、これら規制要件を満たす有効手段の一つに位置づけられます。
実証事例と評価結果
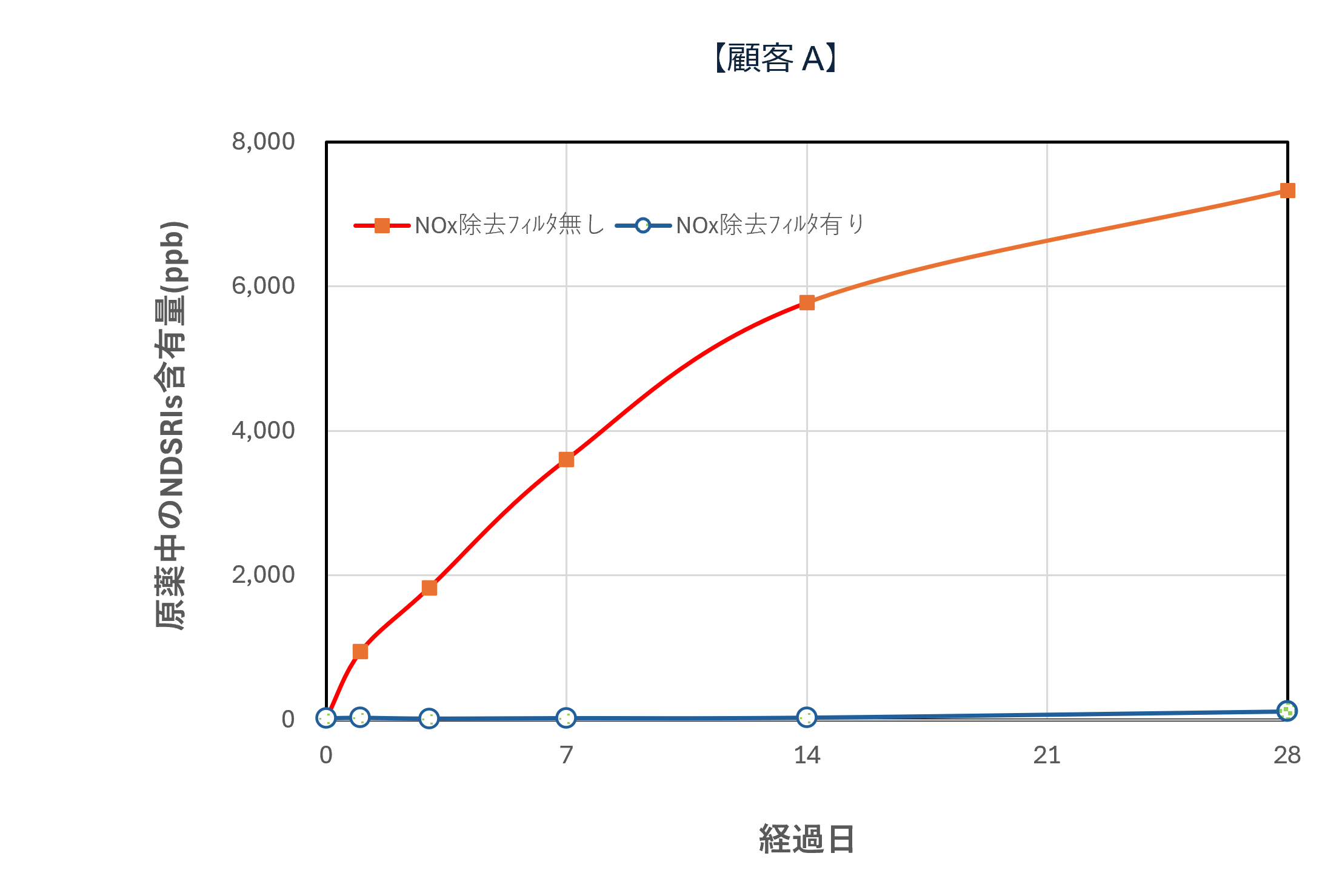
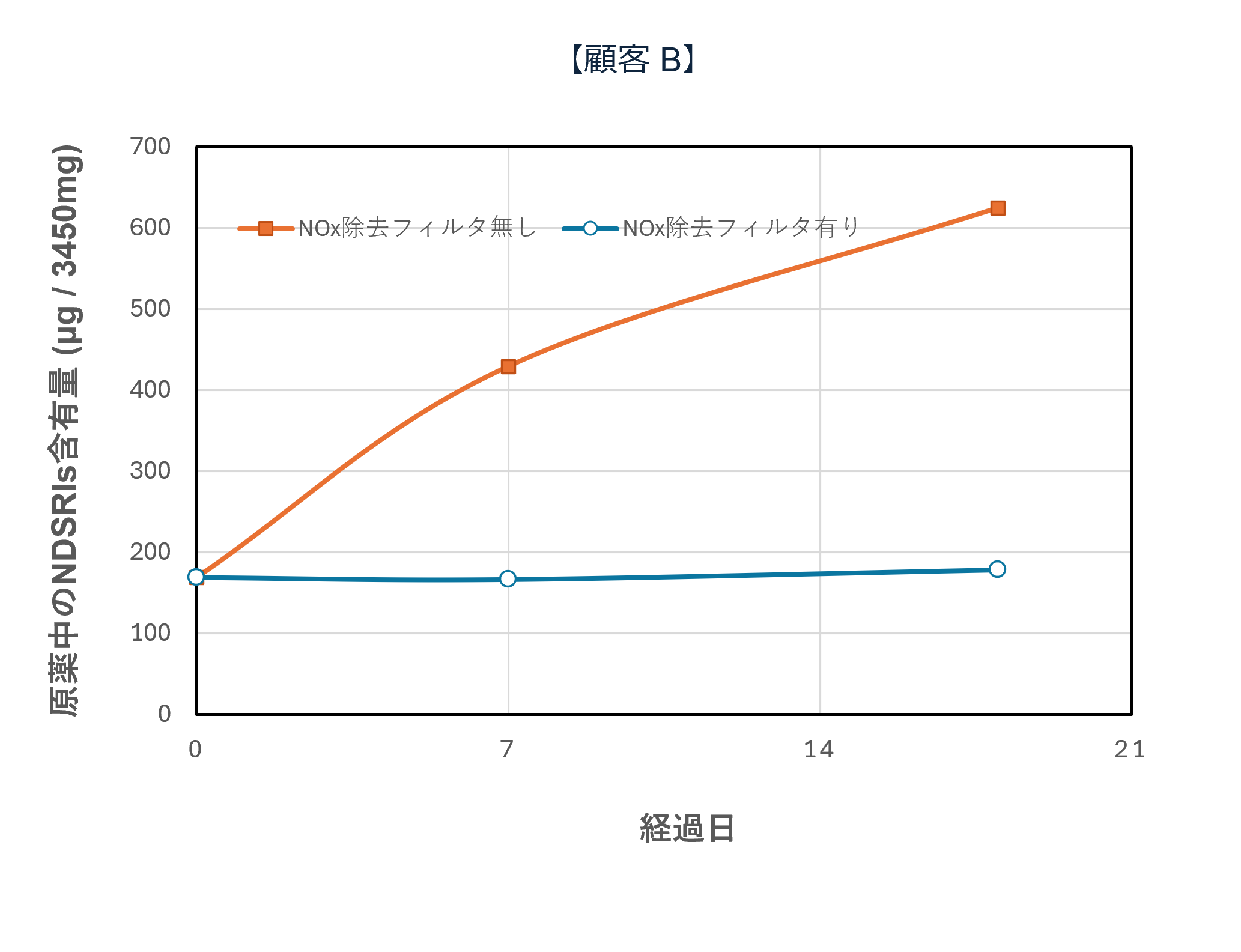
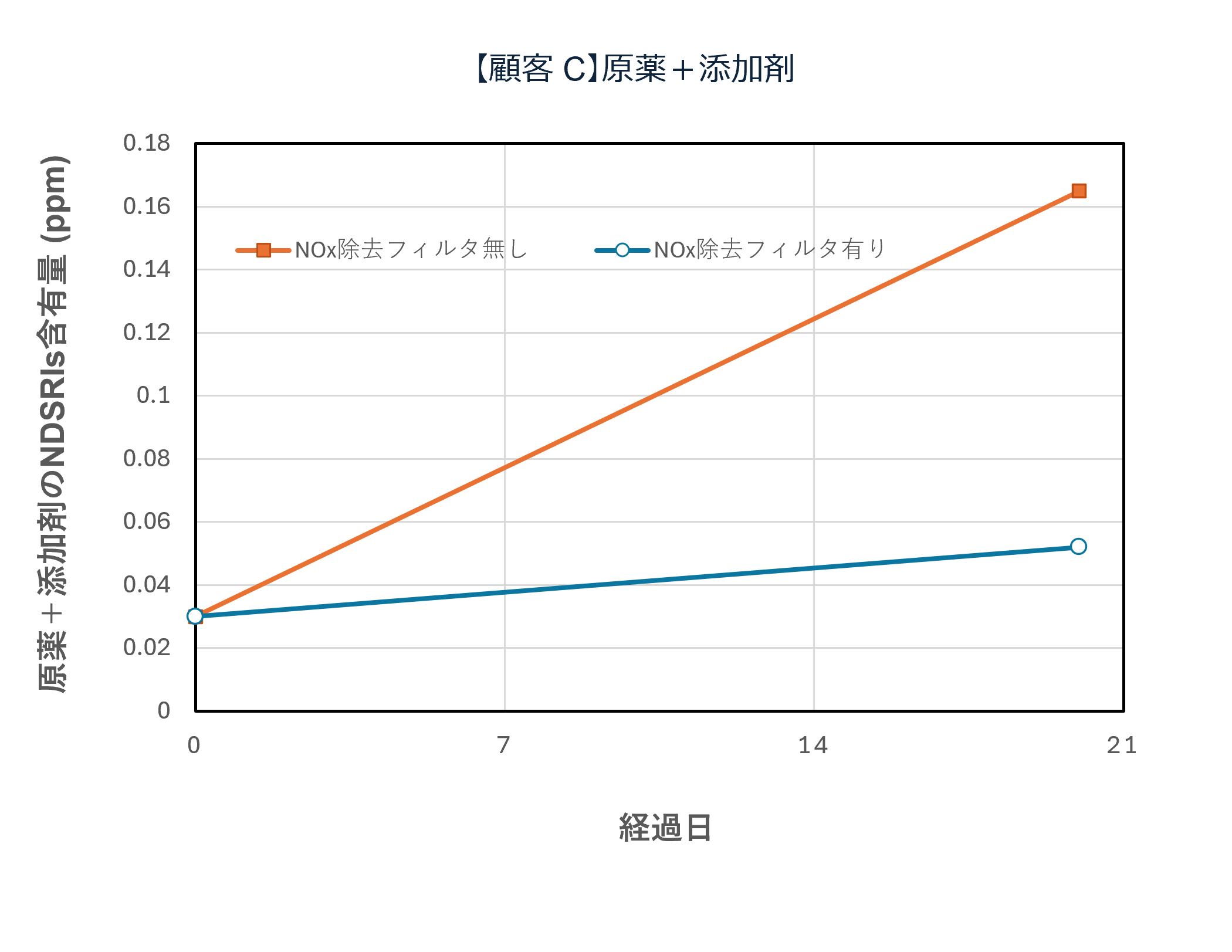
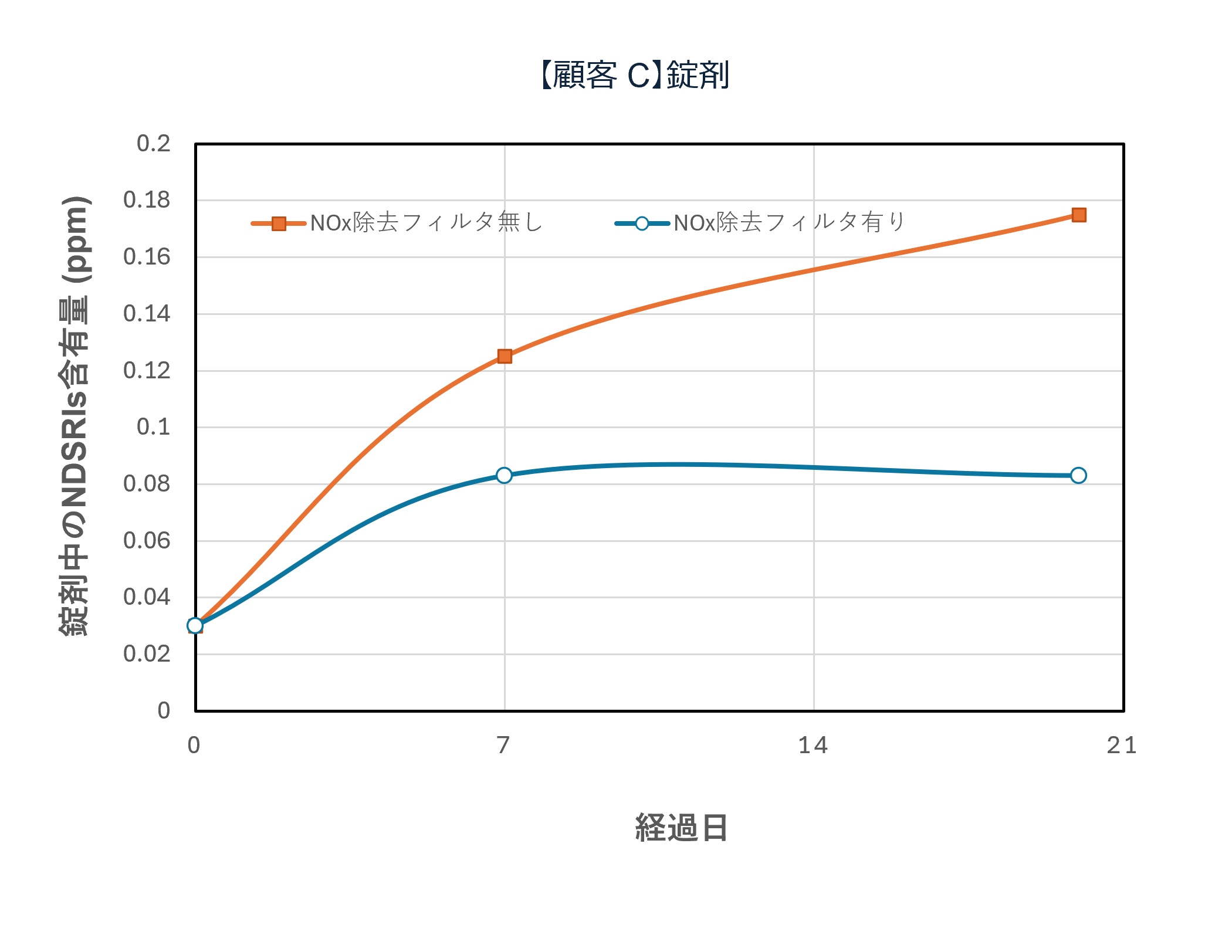
国内の某製薬企業における実証事例では、NOx除去フィルタの導入によって 空気中NOx濃度が大幅に低減され、原薬・製剤中のニトロソアミン関連不純物(NDSRIs:Nitrosamine Drug Substance Related Impurities)の濃度低下に成功しています。
さらに、実験規模(テスト機)での比較試験において、フィルタあり/なしでの挙動差が認められ、時間経過によるNDSRIs濃度増加を抑制できることが確認されています。
テスト機によるNOx除去フィルタシステム性能評価(一例)
テスト機によるNOx除去フィルタの有無で原薬中・錠剤中のNDSRIs(ニトロソアミン不純物)含有量の変化を確認
| 【原薬中・錠剤中のNDSRIs含有量と経時変化(ppb)】 | |
 |
 |
 |
|
 |
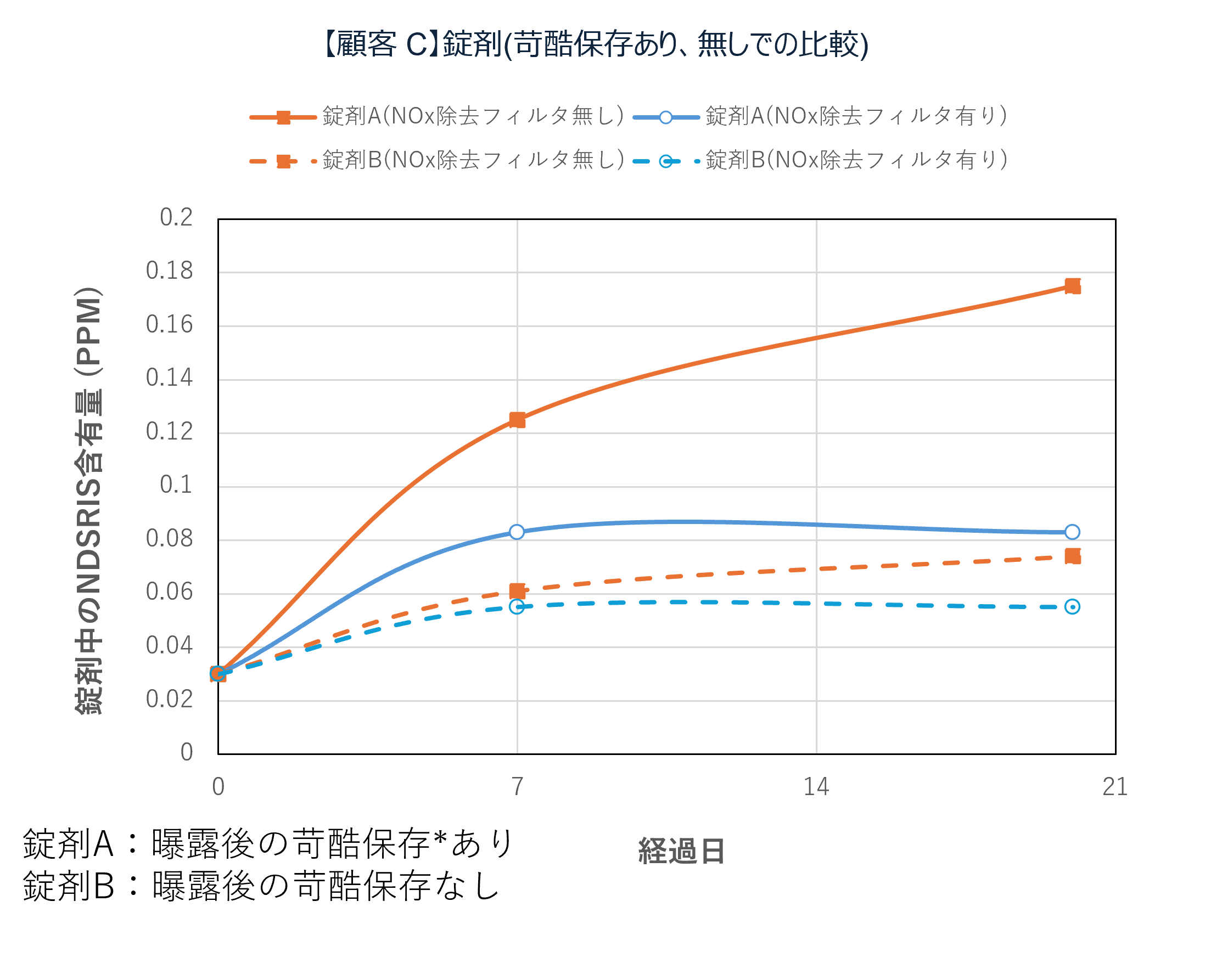 |
*フィルター上流下流に保存期間の日数曝露後,60℃密栓で1週間保存
*これらの検証内容は、学術誌にも掲載され、技術的・科学的信頼性が裏付けられています。
※出典:同社技術資料・学術誌掲載情報(別途)
5.GMP対応・品質向上支援 ― 製造環境から考えるリスクマネジメントの方向性
医薬品の品質を確保するためには、原料や製造設備の管理に加えて、製造環境そのものをGMPに基づいて最適化することが求められます。
ニトロソアミン問題をはじめとする近年の品質課題は、製造プロセスの外側、すなわち「空気環境」や「設備共用による交差汚染」「包装・保管時の雰囲気」など、従来は見過ごされがちだった要素にも目を向ける必要性を示しています。
GMP対応の観点からは、以下のような取り組みが重要とされています。
- クリーンルームや製造ラインの大気環境を適正に維持することにより、製造・保管工程での不純物生成リスクを抑制する。
- 空気中NOxなどの環境変動要因を管理し、交差汚染や工程間汚染を防ぐことで、製品品質の一貫性を高める。
- 品質保証(QA)や製造部門が協働して環境リスクを可視化し、製造後の監査や当局対応の負担を軽減する体制を整備する。
- 原薬・製剤中のNDSRIs(ニトロソアミン関連不純物)の経時的変化をデータで把握・管理することで、より透明性の高い品質保証体制を構築する。
こうした考え方のもと、製造環境の空気質を管理する技術やNOx除去システムは、単なる設備投資ではなく、GMP遵守・品質保証の一環としてのリスクマネジメント手法として位置づけられつつあります。
環境制御技術を活用した包括的な品質管理は、今後の医薬品製造において「予防的品質保証」を実現する鍵となるでしょう。
まとめ
医薬品中のニトロソアミン類混入は、規制強化の流れの中で製薬メーカーが直面する重大な品質リスクとなっています。合成・設備・包装・保管など多様なリスク要因が重なっており、従来の製造方法変更や設備専用化だけでは十分な対策とはなりにくい状況です。
こうした中で、日本無機の NOx除去ケミカルシステムは、製造環境という観点からの補完的・実用的な対策ソリューションとして有効に機能する可能性があります。製造工程全体を俯瞰した上で、空気環境を含む「見えづらい汚染源」を制御することで、製薬メーカーの品質保証・GMP対応・リスク低減を支援する新たなアプローチと言えるでしょう。
今後、規制対応がさらに厳格化する中で、環境制御を含む総合的なアプローチの必要性がますます高まると考えられます。
参考文献・出典
・厚生労働省「医薬品におけるニトロソアミン類の混入リスクへの対策」 (PMDA) PMDA+1
・厚生労働省「医薬品におけるニトロソアミン類の混入リスクに関する自主点検」通知・ガイダンス 厚生労働省+1
・FDA「Information about nitrosamine impurities in medications」 U.S. Food and Drug Administration+1
・学術レビュー “Nitrosamine impurities in pharmaceuticals: An empirical review …” PubMed
・学術レビュー “A comprehensive review on nitrosation pathways…” biotech-asia.org
・日本無機株式会社サービス紹介ページ(IVEXL)
ご執筆者様の会社・製品サービスのご紹介はこちら

(ライフサイエンス企業向け情報プラットフォーム iVEXLへリンクします)
フィルタトップメーカーとして世界No.1の技術で「薬の安全」を支える日本無機株式会社。
ダイキングループの一員として、国内初のHEPAフィルタ、世界初のULPAフィルタを開発・製造してきたリーディングカンパニーです。電子・半導体、病院、食品など多岐にわたる業界でサービスを提供されています。



コメント
/
/
/
コメント