再生医療等製品の品質保証についての雑感【第75回】

第75回:細胞製造の品質マネジメントシステム (5)
~ 製品の均質と原材料の均一と細胞原料 (1)~
はじめに
品質マネジメントシステムの構築では、最終製品が「均質」であることを目標とします。均質とは、質が同じであることです。またその原材料は「均一」であることが望ましいです。均一とは、全く同じであることです。これは、近年では同等性/同質性評価として避けては通れない話題です。マルチポテンシーアッセイなどの有効性と相関するCQA代替(アウトプット)の議論は進んでいると認識しますが、プロセスとそのインプット(原材料)に関する議論は意外と少ないかなと感じています。
● あらためて製品の均質性を確保する方法を考える
製品の均質性を考慮する場合、先ずは大雑把に、製造(製剤)の原薬(製品の成分)が【同定可】か、【同定不可】か、という区分で分類します。「同定」とは、対象を一部ではなく、全てを定量的かつ網羅的に評価できることを意図します。一般的には、原薬が【同定可】では低分子医薬品を、【同定不可】では組成が複雑な高分子医薬品などを想定するイメージです。
全体イメージを下図に示します。原薬、すなわち製品特性が【同定可】の場合、目的物質のみが単独で獲得可能であり、製品の均質は純度と不純物の内容に依存すると定義します。【同定可】の分類では、均質は材料が「均一」であることをいかに確保するかが重要となります。これにより、製造のロットが異なっても、限りなく「同一」の製品が供給可能であると認識します。
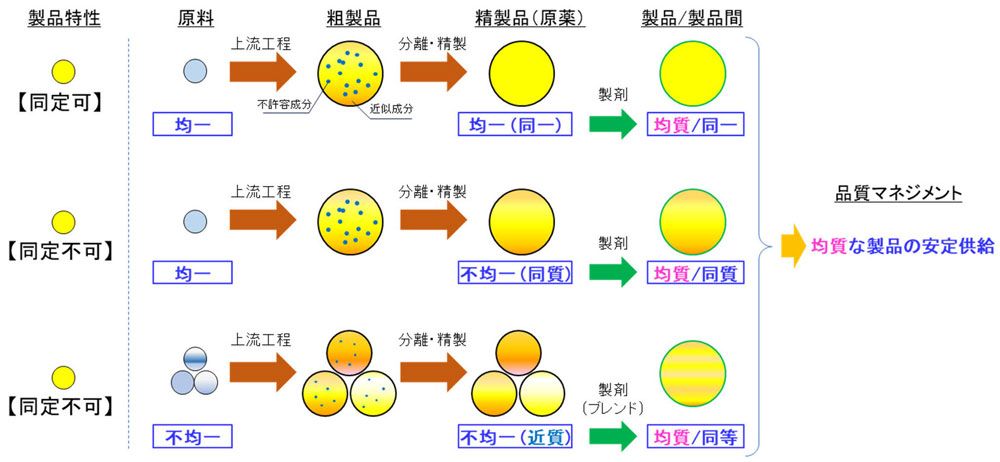
図. 製品(原薬)の均質性確保のために選択される製造プロセスの一般的な考え方
注)同等と同質について
規制における品質の定義では同等と同質は区別されません。規制では「同等/同質」として、品質特性において類似性が高く、品質(安全性と有効性)に及ぼす影響が生じないことが科学的に判断できることと定義しており、詳細な区別は品質を管理する事業者側のマネジメントに依存すると認識します。ここでは、一般的な概念に準じ、「同等」は同レベルで等しいこと、「同質」は同じ内容で等しいことと定義しています。
これに対し、製品特性が【同定不可】では、目的物質のみを単離することが困難であり、「同一の製品」の達成は難しいと考えます。また【同定不可】の分類では、さらに2つの特性に区分できます。1つは、材料(原薬)の製造プロセスにおいて、バッチ毎で物性(分子量、配列、含量など)を相同にする精密な制御、すなわち均一の原料の獲得が容易である(あるいは要求される)製品で、もう1つは、原料が不均一である、あるいはそれ以外の理由で物性を相同に制御するのが(あるいは費用対効果などでその採用が)困難な製品となります。


コメント
/
/
/
コメント