GMPヒューマンエラー防止のための文書管理【第74回】

文書管理
1.手順書
GMP省令が改正され、安定性モニタリングや供給者管理等新規の手順書が加わり、17の手順書が必須手順書となった。
(手順書等)
第八条 製造業者等は、製造所ごとに、次に掲げる手順について記載した文書(以下「手順書」という。)を作成し、これを当該製造所に適切に備え置かなければならない。
一 構造設備及び職員の衛生管理に関する手順
二 製造工程、製造設備、原料、資材及び製品の管理に関する手順
三 試験検査設備及び検体の管理その他適切な試験検査の実施に必要な手順
四 安定性モニタリングに関する手順
五 製品品質の照査に関する手順
六 原料及び資材(以下「原料等」という。)の供給者の管理に関する手順
七 製造業者等の委託を受けて試験検査その他の製造・品質関連業務の一部を行う他の事業者
(以下「外部委託業者」という。) の管理に関する手順
八 製造所からの出荷の管理に関する手順
九 バリデーションに関する手順
十 第十四条の変更の管理に関する手順
十一 第十五条の逸脱の管理に関する手順
十二 第十六条の品質情報及び品質不良等の処理に関する手順
十三 回収等の処理に関する手順
十四 自己点検に関する手順
十五 教育訓練に関する手順
十六 文書及び記録の作成、改訂及び保管に関する手順
十七 その他適正かつ円滑な製造・品質関連業務に必要な手順
第八条 製造業者等は、製造所ごとに、次に掲げる手順について記載した文書(以下「手順書」という。)を作成し、これを当該製造所に適切に備え置かなければならない。
一 構造設備及び職員の衛生管理に関する手順
二 製造工程、製造設備、原料、資材及び製品の管理に関する手順
三 試験検査設備及び検体の管理その他適切な試験検査の実施に必要な手順
四 安定性モニタリングに関する手順
五 製品品質の照査に関する手順
六 原料及び資材(以下「原料等」という。)の供給者の管理に関する手順
七 製造業者等の委託を受けて試験検査その他の製造・品質関連業務の一部を行う他の事業者
(以下「外部委託業者」という。) の管理に関する手順
八 製造所からの出荷の管理に関する手順
九 バリデーションに関する手順
十 第十四条の変更の管理に関する手順
十一 第十五条の逸脱の管理に関する手順
十二 第十六条の品質情報及び品質不良等の処理に関する手順
十三 回収等の処理に関する手順
十四 自己点検に関する手順
十五 教育訓練に関する手順
十六 文書及び記録の作成、改訂及び保管に関する手順
十七 その他適正かつ円滑な製造・品質関連業務に必要な手順
GMP3基準書の名称が変更され、手順書となったが、文書名のみの変更は求められていない。品質システムやリスクマネジメント、CAPAなどは手順書として求められていないが、多くの製造所ですでに、所持している。GMP省令改正を根拠として手順書を変更する必要はなく、製造所の管理としてリスクマネジメントやCAPAは無論のこと、品質システムが適切に稼働する体制を構築しなければならない。
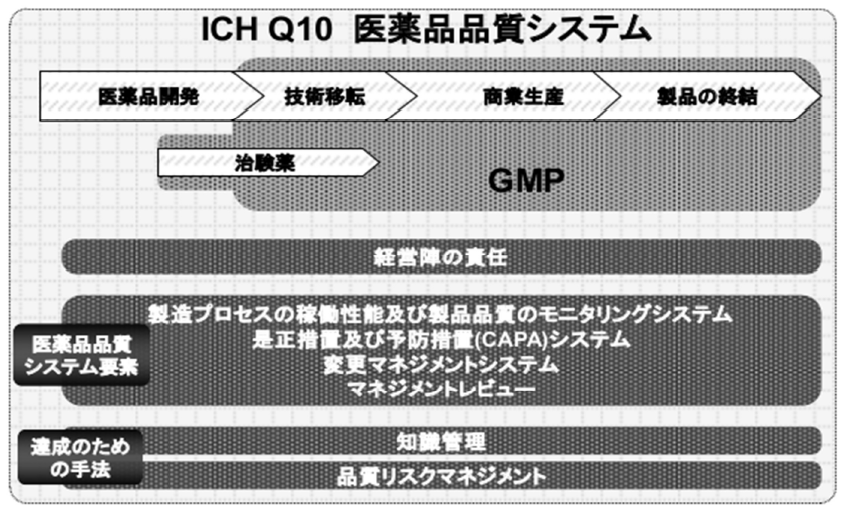
<図1 ICH Q10 医薬品品質システム>
経営者のもと、モニタリングシステム、CAPAシステム、変更マネジメントシステム、マネジメントレビューが稼働するよう管理しなければならない。それらを達成するために、知識管理、品質リスクマネジメントに基づき、管理することになる。製造所の規模、職員人数、生産品目、生産量などが異なり、適切に管理するために製造所ごとにその管理方法を定め、手順書を作成しなければならない。製造所により、手順書が異なるのは当然で、その製造所としての管理体制を構築し、必要な手順書を作成しなければならない。そのために、製造所の生産規模に合致するかリスク分析をし、品質方針、目標を定めなければならない。しかし、規模が異なるのに、製造販売業者が自社の基準と同一の手順を求めることが多い。まず、その製造所自ら、どのような管理が必要なのかを自覚しなければならない。


コメント
/
/
/
コメント